
题目列表(包括答案和解析)
12、答案:A
解析:醇羟基、酚羟基、羧基均能与金属钠溶液反应;酚羟基和羧基均能与氢氧化钠溶液反应,而醇羟基不能与氢氧化钠溶液反应;只有羧基能与NaHCO3溶液反应,故A选项正确。
11、答案:D

 解析:根据图象知,H2A溶液稀释100倍,溶液PH由2增至4,说明H2A是强酸。而H2B溶液稀释200倍,溶液PH增加2个单位,说明H2B为弱酸。A选项,H2A是强电解质,完全电离,电离方程式为H2A 2H++A2-,A选项错误;B选项,HA- H++A2-,溶液中不存在H2A、HA-,B选项错误;C选项,NaHA和NaHB的物质的量浓度不一定相等,所以,离子浓度关系不确定,C选项错误;D选项,H2B是弱酸,其钠盐水溶液呈碱性,D选项正确。
解析:根据图象知,H2A溶液稀释100倍,溶液PH由2增至4,说明H2A是强酸。而H2B溶液稀释200倍,溶液PH增加2个单位,说明H2B为弱酸。A选项,H2A是强电解质,完全电离,电离方程式为H2A 2H++A2-,A选项错误;B选项,HA- H++A2-,溶液中不存在H2A、HA-,B选项错误;C选项,NaHA和NaHB的物质的量浓度不一定相等,所以,离子浓度关系不确定,C选项错误;D选项,H2B是弱酸,其钠盐水溶液呈碱性,D选项正确。
10、答案:C
解析:NaCl溶液作电解液,铝作负极,负极反应是铝失去电子变为Al3+,NaOH溶液作电解液,Al3+与过量的碱反应生成AlO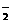 ,因此负极反应为:
,因此负极反应为:
 Al+4OH--3e-
AlO
Al+4OH--3e-
AlO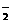 +2H2O,A选项错误;该燃料电池正极发生的反应均为:
+2H2O,A选项错误;该燃料电池正极发生的反应均为:

 O2+2H2O+4e-
4OH-,B选项错误;以NaOH溶液为电解液时,该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-
4AlO
O2+2H2O+4e-
4OH-,B选项错误;以NaOH溶液为电解液时,该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-
4AlO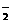 +2H2O,溶液pH降低,C选项正确;电池工作时,电子从负极
+2H2O,溶液pH降低,C选项正确;电池工作时,电子从负极 出来经过外电路流到正极,D选项错误。
出来经过外电路流到正极,D选项错误。
9、答案:D
 解析: A(g)+2B(g) 2C(g)
解析: A(g)+2B(g) 2C(g)
起始(mol) 1 n 0
转化(mol) x 2x 2x
平衡(mol) (1-x)(n-2x) 2x
2x=amol, x=0.5amol,αA:αB=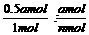 ≠1:2,A选项错误;该反应的反应物和产物都是气体,气体总质量不变,在恒压条件下,气体体积由大到小,则起始气体密度小于
≠1:2,A选项错误;该反应的反应物和产物都是气体,气体总质量不变,在恒压条件下,气体体积由大到小,则起始气体密度小于 平
平 衡时气体密度,B选项错误;在恒温恒压条件下,采用一边倒计算,开始投入反应物浓度之比相等,达到同一平衡状态,即反应物转化率相等,故有
衡时气体密度,B选项错误;在恒温恒压条件下,采用一边倒计算,开始投入反应物浓度之比相等,达到同一平衡状态,即反应物转化率相等,故有 ,n(C)=3amol,D选项正确。
,n(C)=3amol,D选项正确。
8、答案:C
解析:A选项,溶液呈橙黄色,说明有溴生成;加入氯化钡溶液产生白色沉淀,说明有硫酸钡、碳酸钡或BaSO3生成,在原溶液中加铝粉产生气体,说明原溶液可能含有大量
OH-,也可能含有大量H+,气体可能是氢气,也可能是氮的氧化物,SO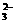 与H+、“H++NO
与H+、“H++NO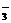 ”均不能大量共存,A选项错误;B选项,该溶液可能呈酸性或碱性,在碱性条件下,镁离子、铜离子不能大量存在,而在酸性条件下,高锰酸根离子能氧化Br-,B选项错误;D选项,该溶液可能是酸性溶液,也可能是碱性溶液,碱性溶液中Al3+、NH
”均不能大量共存,A选项错误;B选项,该溶液可能呈酸性或碱性,在碱性条件下,镁离子、铜离子不能大量存在,而在酸性条件下,高锰酸根离子能氧化Br-,B选项错误;D选项,该溶液可能是酸性溶液,也可能是碱性溶液,碱性溶液中Al3+、NH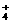 不能大量存在,D选项错误。
不能大量存在,D选项错误。
7、答案:B
解析:溶质溶解在1L水中形成的溶液体积不等于1L,A错;Fe3O4中铁的平均化合价为8/3,被硝酸氧化后生成+3价铁,0.15molFe3O4转移电子的物质的量为0.15×(3-8/3)×3=0.5(mol),B对;醋酸是电解质,能部分电离,C错;1.2g NaHSO4为0.01mol,它的阴阳离子分别为Na+、HSO
NaHSO4为0.01mol,它的阴阳离子分别为Na+、HSO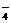 ,D错。
,D错。
6、答案:B
解析:太阳能、风能、核能、生物能、地热能等均属于新能源,A正确;图中甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想,C正确;减少化石能源的使用 能有效减少CO2的排放量,是实现“低碳经济”的重要途径,D正确;“低碳”意指较低的温室气体排放,并非指采用含碳量低的烃类化合物作燃料,B不正确。
能有效减少CO2的排放量,是实现“低碳经济”的重要途径,D正确;“低碳”意指较低的温室气体排放,并非指采用含碳量低的烃类化合物作燃料,B不正确。
30、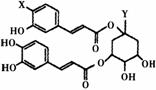 (16分)洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图所示,其中X与Y是不为H的官能团或基团。请回答下列问题:
(16分)洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图所示,其中X与Y是不为H的官能团或基团。请回答下列问题:
(1)洋蓟素分子式可表示为C2n+1H2nOn(n为正整数),洋蓟素相对分子质量不大于520;则洋蓟素分子式为 ;
(2)洋蓟素在碱性条件下水解,其中生成的一种有机物A能发生下列变化,已知B和C所含碳原 子个数相等。
子个数相等。
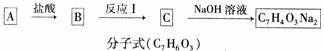
①反应Ⅰ的反应条件为 ,C的结构简式为 ;
②X与Y的名称分别为X ,Y ;
③有关洋蓟素说法错误的是 (填写字母);
a、是一种高分子化合物 b、可以使酸性高锰酸钾和溴水褪色
c、能与氯化铁发生显色反应 d、洋蓟素水溶液呈酸性
e、不能与新制Cu(OH)2生成砖红色沉淀
(3)洋蓟素在酸性条件下水解,其中生成一种有机物E。已知邻苯二酚与F物质发生加成反应可生成E,其化学方程式为:
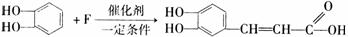
①写出F的结构简式: ;
②E与足量浓溴水发生反应的化学方程式为: ;
③写出同时满足下列条件E的所有同分异构体的结构简式: 。
(i)苯环上的一氯代物只有一种;(ii)除苯环外不含其他的环;(iii)能与碳酸氢钠溶液反应生成二氧化碳
29、(12分)请你选择适当的化学试剂和实验用品,设计实验装置进行实验,证明过氧化钠可作供氧剂。
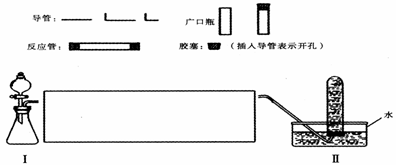 (1)在下面方框中完成该实验装置简易示意图(夹持装置,连接胶管不必画出,如需要加热的仪器下方用△标出),按气流方向在所画的仪器下方标出字母①、②等;其他可选用的仪器(数量不限)简易表示如下:
(1)在下面方框中完成该实验装置简易示意图(夹持装置,连接胶管不必画出,如需要加热的仪器下方用△标出),按气流方向在所画的仪器下方标出字母①、②等;其他可选用的仪器(数量不限)简易表示如下:
(2)根据上述装置图补充该表(可以填满,也可以不填满,还可以补填)。
|
仪器符号 |
仪器中所加物质 |
作用 |
|
Ⅰ |
石灰石、盐酸 |
石灰石与盐酸作用生成CO2 |
|
① |
|
|
|
② |
|
|
 |
|
|
|
|
|
|
(3)证明装置Ⅱ中所收集气体是氧气的实验操作是:
28、(20分)在下列物质转化中,反应条件和部分产物已略去。
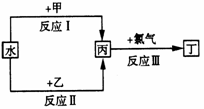
(1)若甲、乙是化合物,且反应Ⅲ是工业制造漂白粉的反应:
①若反应Ⅱ是化合反应,乙可与硫酸铵共热反应制氨气,则此反应的化学方程式为
②反应Ⅲ的化学方程式为 ,在工业生产中,选择丙溶液还是丙悬浊液来吸收氯气: ,理由是 。
(2)若甲、乙是两种常见的金属,反应Ⅲ是工业制盐酸的反应。
①反应Ⅱ中,乙与水在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式为 。工业上制备乙单质的一般方法是 。
A、热分解法 B、热还原法 C、电解法 D、物理法
②反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种透过蓝色钴玻璃片观察到焰色反应呈紫色的物质,在小烧杯里进行甲与水反应的实验,注意事项是 ,观察到的主要现象是 。
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或弱)。
(3)若甲、乙都是由两种短周期元素组成的离子化合物,反应Ⅲ用于制盐酸。
①反应Ⅰ在常温下进行,除丙外,还有一种产物是可溶性弱碱,则甲的化学式为 。
②反应Ⅱ在常温下进行,除丙外,还有一种产物是强碱,则反应Ⅱ的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com