
题目列表(包括答案和解析)
5.某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
|
检测序号 |
溶液中检测出的离子组合 |
|
第一次 |
KCl、K2SO4、Na2CO3、NaCl |
|
第二次 |
KCl、AlCl3、Na2SO4、K2CO3 |
|
第三次 |
Na2SO4、KCl、K2CO3、NaCl |
则下列说法合理的是( )
A.三次检测结果都正确
B.该溶液中的阳离子无法判断
C .为了检验SO,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
.为了检验SO,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D.为了确定是否存在CO,可以向其中滴加 CaCl2溶液,观察是否有沉淀现象
CaCl2溶液,观察是否有沉淀现象
[答案] C
4.化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题。下列实验问题处理方法正确的是 ( )
A.制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热
B.在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度
C.白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱
D.给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
[解析] 制氧气时排水法收集氧气后出现倒吸现象,应持续加热,A项错;可燃性气体点燃前必须检验气体的纯度,B项错;白磷易燃,应放入指定的装置中,C项错。
[答案] D
3.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是 ( )
A.MgMg(NO3)2
B.MgMgCl2Mg(OH)2Mg(NO3)2
C.MgMgOMg(NO3)2
D.MgMgSO4Mg(NO3)2
[解析]“绿色化学”要求环保,不能造成污染,成本要低,B项错
[答案] C
2.某学生的实验报告中有下列数据,其中合理的是 ( )
①用托盘天平称取11.7g氯化钠 ②用100mL的量筒量取21.48mL盐酸 ③用容量瓶配制216mL 1mol·L-1的氯化钠溶液 ④用酸式滴定管量取25.00mL H2SO4溶液⑤用广泛pH试纸测定H2SO4溶液的pH的3.2
A.①④ B.②④ C.③⑤ D.②⑤
[解析] ②中量筒读数只能读到0.1mL;③中用容量瓶配制氯化钠溶液不能配成216mL,可以是250mL;⑤中用广泛pH试纸测定溶液的pH只能准确到整数。
[答案] A
1.下列有关实验操作说法中,不正确的是 ( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口 倒出
倒出
B.可用渗析的方法除 去淀粉中混有的少量NaCl杂质
去淀粉中混有的少量NaCl杂质
C.在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中的液体
D.仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的H2SO4和CH3COOH溶液
[解析] 不能用玻璃棒不断搅拌过滤器中的液体,会使过滤不够纯净,可以采用抽滤加快过滤速率。
[答案] C
30、(16分)
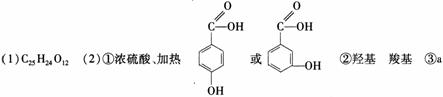
29、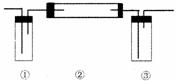 (12分)
(12分)
答案:(1)(2)①饱和碳酸氢钠溶液 除去二氧化碳中的氯化氢
②过氧化钠 过氧化钠与二氧化碳、水蒸气反应产生氧气
③氢氧化钠溶液 吸收未反应的二氧化碳
(3)将Ⅱ中导管移出水面,关闭Ⅰ中分液漏斗 活塞,用拇指堵住试管口中,取出试管,立即用带火星的木条伸入试管口,木条复燃证明试管收集的气体是氧气
活塞,用拇指堵住试管口中,取出试管,立即用带火星的木条伸入试管口,木条复燃证明试管收集的气体是氧气
解析:由于制备二氧化碳是利用盐酸与碳酸钙反应,这样二氧化碳中就可能含有氯化氢,所以为了防止氯化氢干扰,应先除去二氧化碳中的氯化氢。由于气体与固体反应可能不充分,所以与过氧化钠反应后生成的氧气中还可能含有二氧化碳,所以收集氧气前必须先除去二氧化碳气体。
28、(20分)
 答案:(1)①CaO+(NH4)2SO4 CaSO4+2NH3↑+H2O
答案:(1)①CaO+(NH4)2SO4 CaSO4+2NH3↑+H2O
 ②2Ca(OH)2+2Cl2 CaCl2+Ca(ClO)2+2H2O 丙悬浊液 澄清石灰水中氢氧化钙浓度很小,所得产品浓度很小,不经济
②2Ca(OH)2+2Cl2 CaCl2+Ca(ClO)2+2H2O 丙悬浊液 澄清石灰水中氢氧化钙浓度很小,所得产品浓度很小,不经济
 (2)①3Fe+4H2O(g) Fe3O4+4H2 B
(2)①3Fe+4H2O(g) Fe3O4+4H2 B
②烧杯口上盖玻璃片 剧烈反应,液面气体燃烧并发生轻微的爆炸 ③强
 (3)①NH4H ②NaH+H2O NaOH+H2↑(其他合理答案也可)
(3)①NH4H ②NaH+H2O NaOH+H2↑(其他合理答案也可)
解析:(1)反应Ⅲ是工业制漂白粉的反应,说明丙为氢氧化钙,中学能与水反应生成氢氧化钙的物质主要有氧化钙、碳化钙等。(2)反应Ⅲ是工业制盐酸的反应,说明丙是氢气,能与水反应产生氢气的金属有钠、钾、铁等。(3)有一类特殊物质能与水反应生成氢气和碱,这类物质是氢化物,如氢化钠、氢化铵等。
27、(12分)
答案:(1)H: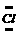 :
:
 (2)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
(2)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O 用湿润的红色石蕊试纸接近容器口,观察到试纸变蓝,证明已收集满
用湿润的红色石蕊试纸接近容器口,观察到试纸变蓝,证明已收集满
 (3)BaO2+H2SO4 H2O2+BaSO4↓
(3)BaO2+H2SO4 H2O2+BaSO4↓

 (4)2H++2e- H2↑ S2O
(4)2H++2e- H2↑ S2O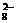 +2H2O H2O2+2HSO
+2H2O H2O2+2HSO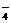
解析:A是氢化物,有2个原子,原子个数比为1:1,且含18电子,则A为HCl;C也为氢化物,有4个原子,原子个数比为1:1,且含18电子,则C为H2O2;B与C的元素种类相同,含有10个电子,则B为H2O;D也含10个电子,有4个原子,与
B(H2O)反应生成一种一元弱碱,则D为NH3。
13、答案:B
解析:首先根据燃烧热的定义判断选项A,根据盖斯定律和相应热化学方程式来计算23g液体酒精燃烧释放出的热量,从化学变化的本质来判断选项C,根据反应物和生成物的总能量来判断选项D 。根据盖斯定律并结合①②③可得:
。根据盖斯定律并结合①②③可得:
 C2H5OH(1)+3O2(g) 2CO2(g)+3H2O(1)
△H= -(O3-Q2+3Q1)kJ/mol,故有23g(0.5mol)液态酒精完全燃烧生成CO2和液态水放出热量为(0.5Q3-0.5Q2+1.5Q1)kJ。
C2H5OH(1)+3O2(g) 2CO2(g)+3H2O(1)
△H= -(O3-Q2+3Q1)kJ/mol,故有23g(0.5mol)液态酒精完全燃烧生成CO2和液态水放出热量为(0.5Q3-0.5Q2+1.5Q1)kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com