
题目列表(包括答案和解析)
1.同周期元素(从左→右)
①电子层数相同,最外层电子由1→8。
②原子半径逐渐减小。
③失电子能力渐弱、得电子能力渐强,即金属性减弱、非金属性增强。金属单质的还原性减弱,例如:Na>Mg>Al与水反应的能力逐渐减弱。非金属单质的氧化性增强,还原性减弱。例如氧化性:Si<P<S<Cl2,还原性:Si>P>S>Cl2。
④最高价氧化物的水化物:碱性减弱、酸性增加。例如:
NaOH、Mg(OH)2、Al(OH)3、H4SiO4、H3PO4、H2SO4、HClO
强碱 中强碱 两性 弱酸 中强酸 强酸 最强酸
⑤气态氢化物的稳定性渐强、还原性渐弱。
例如:稳定性:SiH4<PH3<H2S<HCl;还原性:SiH4>PH3>H2S>HCl。
27.答案解析:(中难)因A原子的L层电子数与K、M层电子数之和相等,所以A的核电荷数为2×8=16,A为硫元素。D原子的K、L层电子数之和等于电子总数的一半,所以D原子的核电荷数是(2+8)×2=20,D为钙元素。根据核电荷数依次增大,并都形成离子,排除氩原子和磷元素,B为氯元素,C为钾元素。A、B、C、D最高价氧化物水化物分别为H2SO4、HClO4、KOH、Ca(OH)2。参考答案归纳如下:
(1) S;Cl;K;Ca(4分,每空1分)
(2) Cl-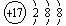 (2分) Ca2+
(2分) Ca2+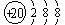 (2分)
(2分)
(3) (3分)
(3分)
(4) 酸性:HClO4>H2SO4 (2分) 碱性:KOH>Ca(OH)2(2分)
应试策略:掌握同周期元素、同主族元素的性质递变规律是解题的关键。
27.(本小题15分) A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四元素的符号依次是A______;B______;C________;D______。
(2)写出B、D元素的离子结构示意图:
B.______________________; D.______________________。
(3)用电子式表示A、C元素形成的离子化合物的过程:
________________________________________________________。
(4)在A、B、C、D最高价氧化物水化物中:
比较其中酸的酸性强弱:____________________________;
比较其中碱的碱性强弱:____________________________。
13.可用于电动汽车的铝?空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
13[解析] 本题考查铝-空气燃料电池的工作原理及其电极反应方程式的书写。本题中电解质溶液显中性或碱性,该燃料电池的正极反应均为:O2+2H2O+4e-===4OH-,A正确;铝作负极,铝失去电子变为铝离子,在NaOH溶液中铝离子会跟过量的氢氧根离子反应生成偏铝酸根离子,因此负极反应为:Al-3e-+4OH-===AlO+2H2O,B错误;以NaOH溶液为电解液时,该燃料电池的总反应为:4Al+3O2+4OH-===4AlO+2H2O,反应过程中消耗了氢氧根离子,所以电解液的pH降低,C错误;燃料电池工作时,电子通过外电路从负极流向正极,D错误。
[答案] A
12.开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如下图所示,下列关于该有机物的说法正确的是
( )
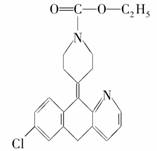
A.该有机物的分子式是C21H20N2O2Cl
B.分子中含有四个六元环,其中有一个是苯环
C.1 mol分子发生水解反应后能得到2 mol新分子
D.1 mol分子发生加成反应需要8 mol H2
12[解析]A项该有机物的分子式是C21H21N2O2Cl ,C项,水解反应,既有酯的水解,又有卤代烃的水解,还可能有肽键的水解,不只得到两种新物质。D项,1 mol该分子最多需要7 mol H2,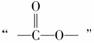 中的
中的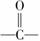 不能与H2加成。
不能与H2加成。
[答案] B
11.设阿伏加德罗常数的数值为NA,下列说法正确的是
( )
A.常温常压下,1 mol氦气含有的核外电子数为4NA
B.一定条件下,0.1 mol铁与0.1 mol Cl2充分反应,转移的电子数约为0.3NA
C.标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
D.标准状况下,NA个NO分子和0.5NA个O2分子混合后气体的总体积为33.6 L
[解析] 由于氦气是单原子分子,故常温常压下,1
mol氦气含有的核外电子数为2NA;由于Cl2的量不足,一定条件下,0.1 mol铁与0.1 mol Cl2充分反应,转移的电子数为0.2NA;因N2和O2都是双原子分子,所以在标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA;因发生反应2NO+O2===2NO2和2NO2  N2O4,标准状况下,NA个NO分子和0.5NA个O2分子混合后气体的总体积应小于22.4 L。
N2O4,标准状况下,NA个NO分子和0.5NA个O2分子混合后气体的总体积应小于22.4 L。
[答案] C
10.下列离子方程式与所述事实相符且正确的是
( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO+CO2+2H2O===Al(OH)3↓+HCO
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FeO+3Cl-+H2O+4H+
10[解析] 有三个因素导致本题比较难:一是本题属于不定项选择题;二是选项涉及过量与不足;三是本题中还涉及一个未知离子方程式(即在教材中是没有的)的正误判断。现逐一分析:选项A中反应可认为是漂白粉的工作原理,失效指的是生成的HClO见光分解,应包括2个反应,A错。选项B中离子方程式未配平,质量不守恒,H+前面的系数应为4,B错。遇到未知反应不要慌张,判断未知反应正确与否的方法是:一要符合三大守恒,即质量守恒、电荷守恒、得失电子守恒;二要注意介质是否正确。对于选项D,很明显在强碱溶液中不可能有H+生成,因此可快速判断该反应是错误的,而对于该反应到底是如何进行的没有必要细究。
[答案] C
9.下列各组离子在指定溶液中能大量共存的是
( )
①无色溶液中:K+、Na+、MnO、SO
②pH=11的溶液中:CO、Na+、[Al(OH)4]-、NO
③加入Al能放出H2的溶液中:Cl-、HCO、SO、NH
④由水电离出的c(OH-)=1.0×10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH、SCN-、HCO
A.①② B.③④
C.②④ D.③⑤
9[解析] ③中能与金属铝反应放出氢气的溶液可能显强酸性也可能显强碱性;④中因为由水电离出的 H+和OH-浓度相等,因此该溶液可能显强酸性也可能显强碱性。
[答案] C
8.向体积为Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是
( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
8[解析] A项,因CH3COOH过量,根据物料守恒可知A项正确;B项,CH3COOH与KOH恰好反应,由质子守恒可知B项正确;C项,因KOH过量,故c(K+)最大,C项错误;根据电荷守恒可得D项正确。
[答案] C
7. 答案解析:(中难)本题考查勒沙特列原理的应用,答案:C。根据左图所示,T2时达到平衡所需时间短,说明温度T2比T1高,因此降低温度平衡正向移动。加入催化剂,不会移动平衡。根据右图所示,P2时达到平衡所需时间短,说明压强P2比P1大,再分析纵坐标,可以看出压强越大C的物质的量分数越小,即增大压强平衡向n(c) %减小的逆向移动,即a<c+d。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com