
题目列表(包括答案和解析)
1.(2009·靖江模拟)红珊瑚栖息于200-2000米的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石.在中国,珊瑚是吉祥富有的象征,一直用来制做珍贵的工艺品.红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是
( )
A.Na B.Fe C.Si D.Cu
解析:红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,而Fe(OH)3是红褐色物质,NaOH是易溶于水的,Cu(OH)2是蓝色的,硅酸盐也不是红色的,故只有B正确.
答案:B
13.将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L, c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求:
(1)此时A的浓度:c(A)=________mol/L.
(2)反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol.
(3)B的平均反应速率:v(B)=________mol/(L·min).
(4)x的值为________.
解析:设混合物中A、B的物质的量为 a mol
3A(g) + B(g)
 xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) a a 0 0
变化量(mol) 1.5 0.5 0.5x 0.5×2
5 min时的量(mol) a-1.5 a-0.5 0.5x 0.5×2
=,即得a=3,即n(A)=n(B)=3 mol,
c(A)=0.75 mol/L
v(B)==0.05 mol/(L·min)
v(C)==0.1 mol/(L·min), x=2.
答案:(1)0.75 (2)3 (3)0.05 (4)2
12.(2009·广东茂名期末测试)某实验小组在进行双氧水分解的实验时发现:大家取相同体积、不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究.
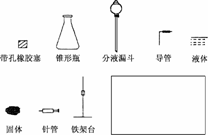
(1)用下列简图,在方框中画出实验装置(含试剂)示意图.
(2)小组经过实验,取得如下数据:
 X
X
Z Y |
0.1 g |
0.3 g |
0.5 g |
|
1.5% |
223
s |
67
s |
56
s |
|
3.0% |
308
s |
109
s |
98
s |
|
4.5% |
395
s |
149
s |
116
s |
(说明:表中X是二氧化锰的质量;Y是指反应停止时的时间;Z是双氧水的含量)
分析表中数据回答下列问题:
①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而________.
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择,理由是____________________________________________.
③该小组的小茂同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是________________________________________________________________________________________.
(提示:可比较相同体积的3.0%与1.5%的双氧水中所含溶质的倍数大小与二者反应结束所用时间的倍数大小作出比较)
解析:(1)据实验目的和所给用品即可画出实验装置如下图所示.
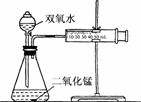
(2)①据表中数据可看出,相同浓度的双氧水随MnO2用量的增加,所用时间减少,即反应加快.
②用0.1 g催化剂的反应速率明显小于用0.3 g和0.5 g催化剂的反应速率,用0.5 g催化剂的反应速率和用0.3 g催化剂的反应速率及所用时间相差不多,但用0.3 g催化剂却节约药品,所以加入0.3 g MnO2为最佳选择.
③从表中数据可知,相同体积3.0%的双氧水中溶质含量约是1.5%的二倍,但反应的时间却比后者反应的时间的二倍小得多,所以据反应速率的计算式可得出应是双氧水的浓度越大,分解速率越快.
答案:(1)
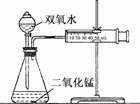
(2)①加快 ②0.3 用0.1 g催化剂的反应速率明显小于用0.3 g和0.5 g催化剂的反应速率;用0.5 g催化剂和用0.3 g催化剂的反应速率及反应时间相差不多,但用0.3 g催化剂节约药品 ③不正确 从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式(v=Δc/Δt)可得出,此实验条件下双氧水的浓度越大分解速率越快
11.用如图所示装置进行下列实验.
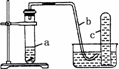
(1)在检查装置气密性后,向试管a中加入10 mL 6 mol/L的稀HNO3和1 g铜片,立即将带有导管的橡皮塞塞紧试管口.请写出在试管a中观察到的现象________________________________________.
(2)实验过程中反应开始时速率缓慢,随后逐渐加快,这是由于____________________________________,当反应进行一段时间后速率又逐渐减慢,原因是______________________________________________.
(3)欲较快地制得NO,可采取的措施是
( )
A.加热 B.使用铜粉
C.稀释HNO3 D.改用浓HNO3
解析:(1)铜与稀HNO3反应时反应的现象从三个方面回答:①固体:铜片逐渐溶解;②液体:溶液变蓝;③气体:开始产生无色气泡,随后变成红棕色.
(2)Cu与稀硝酸的反应速率主要受HNO3浓度及溶液温度的影响,反应开始时,HNO3浓度变化不大,但随着反应的进行溶液温度逐渐升高,故反应速率逐渐加快;反应进行一段时间后,HNO3浓度显著下降,溶液温度变化较小,故反应速率逐渐减慢.
(3)加热及增大Cu的表面积均能加快反应速率,稀释HNO3则减慢反应速率,浓HNO3与Cu反应生成NO2.
答案:(1)铜片逐渐溶解;溶液变蓝;开始产生无色气体,随后变成红棕色
(2)该反应放热,使温度升高,故反应速率加快
反应一段时间后HNO3浓度降低,故反应速率又逐渐减小
(3)AB
10.(2010·福州模拟)对于在一定条件下进行的化学反应:2SO2+O2
 2SO3,改变下列条件,可以提高反应物中活化分子百分数的是
2SO3,改变下列条件,可以提高反应物中活化分子百分数的是
( )
A.增大压强 B.升高温度
C.加催化剂 D.减小反应物浓度
解析:A项中增大压强,实际上增大反应物浓度,只是使得活化分子的浓度增大但百分数不变;D项中减小浓度,反应速率减慢,也不会提高反应物中的活化分子百分数.故A、D都不选.B项中升高温度,使分子的能量增大,原先未达到活化分子能量的分子有些变为活化分子,使其百分数增大,加催化剂,降低活化能,同样可增大活化分子的百分数,故应选B、C.
答案:BC
9.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述中正确的是
( )
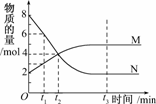
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
解析:从图象可知,t1时,N的物质的量是6
mol,M的物质的量是3
mol,故N的浓度是M浓度的2倍是正确的;同时也可得出反应的化学方程式为:
2N
 M;t2时,M、N的物质的量虽然相等,但尚未达到平衡,因为此时M的物质的量还在增大,N的物质的量还在减小;t3时,M、N的物质的量保持不变,说明已达到平衡状态,则正反应速率等于逆反应速率.
M;t2时,M、N的物质的量虽然相等,但尚未达到平衡,因为此时M的物质的量还在增大,N的物质的量还在减小;t3时,M、N的物质的量保持不变,说明已达到平衡状态,则正反应速率等于逆反应速率.
答案:D
8.(2009·泰川模拟)500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.下列说法正确的是
( )

A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲线变化可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25 min时,分离出0.1 mol的氨气
D.在25 min时平衡正向移动,但达到新平衡后NH3的体积分数比原平衡小
解析:A中N2的平均反应速率为:=0.0025 mol/(L·min);B中从10 min到20 min反应速率骤然增大,可能使用了催化剂;C中25 min时,氨气的物质的量从0.3 mol降至0.2 mol,故应分离出0.1 mol NH3;D中ω(NH3)25 min==
ω(NH3)新平衡==,
而<,故D错.
答案:BC
7.将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)
 NH3(g)+HI(g)、2HI(g)
NH3(g)+HI(g)、2HI(g)
 H2(g)+I2(g).2 min后,化学反应达到平衡,测知c(H2)为0.5 mol/L,c(HI)为4
mol/L,若上述反应速率用NH3的浓度变化值表示,则下列速率数据正确的是
H2(g)+I2(g).2 min后,化学反应达到平衡,测知c(H2)为0.5 mol/L,c(HI)为4
mol/L,若上述反应速率用NH3的浓度变化值表示,则下列速率数据正确的是
( )
A.0.5 mol/(L·min) B.2.0 mol/(L·min)
C.2.5 mol/(L·min) D.5.0 mol/(L·min)
解析:由化学方程式可知NH4I分解产生的NH3和HI的物质的量相等,而生成的HI的总物质的量应等于其平衡时的物质的量与分解消耗的物质的量之和,由于反应前后体积不变,故有Δc(NH3)=c(HI平衡)+c(HI消耗)=4 mol/L+0.5 mol/L×2=5 mol/L,所以v(NH3)==2.5 mol/(L·min).
答案:C
6.反应A+3B===2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol/(L·s) ②v(B)=0.6 mol/(L·s) ③v(C)=0.4 mol/(L·s) ④v(D)=0.45 mol/(L·s)
其中,反应进行得最快的是
( )
A.① B.②
C.③ D.④
解析:据①v(A)=0.15 mol/(L·s),②中v(A)=v(B)=0.2 mol/(L·s),③中v(A)=v(C)=0.2 mol/(L·s),④中v(A)=v(D)=0.225 mol/(L·s)
故反应最快的为④.
答案:D
5.(2009·哈尔滨模拟)在容积不变的某2 L密闭容器中,充入5 mol H2和N2的混合气体,在一定条件下,5 min后反应达到平衡,此时容器内压强是反应前的.则下列说法不正确的是
( )
A.从反应开始到平衡时,用H2表示平均反应速率为0.15 mol/(L·min)
B.反应达到平衡时,NH3的物质的量浓度是0.5 mol/L
C.反应达到平衡时,N2和H2的物质的量之比一定为1∶3
D.反应达到平衡时,反应物和生成物的总的物质的量之比为3∶1
解析:从反应开始到达平衡压强变为反应前的,则反应后气体量为4 mol,经反应生成了1 mol NH3,选项A,v(H2)==0.15 mol/(L·min),A正确;选项B,达平衡时,NH3的浓度为0.5 mol/L,B正确;选项C,反应掉的N2和H2的物质的量之比为1∶3,平衡时,N2和H2的物质的量之比不一定为1∶3,C错误;选项D,平衡时,N2、H2总物质的量为3 mol, NH3为1 mol,反应物与生成物的总物质的量之比为3∶1,D正确.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com