
题目列表(包括答案和解析)
9.(2009·江南十校高三联考)氧化铁和氧化铜混合物m g,加3 mol/L盐酸溶液100 mL,恰好完全溶解,若m g的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为
( )
A.(m-1.6) g B.(m-2.4) g
C.(m-3.2) g D.无法确定
解析:依题意加入3 mol/L盐酸溶液100 mL,恰好完全溶解,则生成氯化铁和氯化铜,氯离子的物质的量为0.3 mol,利用“价态替换”,即这些金属离子与氧原子结合,则需氧原子0.15 mol,即m g金属氧化物中含有0.15 mol氧原子,故金属共有(m-2.4) g.
答案:B
8.(2009·德州检测)在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水.以下叙述正确的是
( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C.还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3∶2∶3
D.明矾属于硫酸盐,含结晶水,是混合物
解析:A项铝热剂是难熔金属氧化物和铝组成的混合物,不一定是由三氧化二铁和铝组成;B项检验三氧化二铁的操作步骤为:样品→粉碎→加盐酸溶解→滴加KSCN溶液;D项明矾含有结晶水,但是纯净物;在还原Fe2O3时,1 mol H2失去2 mol电子,1 mol Al失去3 mol电子,1 mol CO失去2 mol电子,所以据得失电子守恒即可判断C正确.
答案:C
7.某同学设计下列方法对A盐的水解液进行鉴定:
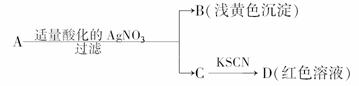
由此得出的结论中,不正确的是
( )
A.D溶液中存在Fe(SCN)3
B.滤液中有Fe3+
C.B为AgBr
D.A一定为无氧酸盐FeBr2
解析:根据B、D现象可确定A是由Fe3+和Br-或由Fe2+和Br-组成的盐.
答案:D
6.a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
( )
A.1∶7 B.7∶1 C.7∶8 D.8∶7
解析:根据题意,设与CuSO4反应的铁为x mol,与H2SO4反应的铁为y mol,
Fe+CuSO4===FeSO4+Cu
x x
Fe+H2SO4===FeSO4+H2↑
y
可以得出下列关系式:56(x+y)=64x
解得x∶y=7∶1.
答案:B
5.在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是
( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
解析:本题可据离子共存来判断,因为Fe粉过量,则无Fe3+、Cu2+、H+,故选C.
答案:C
4.某稀溶液中含有Fe(NO3)2、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示,则稀溶液中Fe(NO3)2、Cu(NO3)2、HNO3物质的量浓度之比为
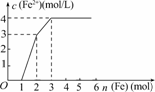
( )
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
解析:加入Fe粉的过程中发生的反应依次为:
Fe+4HNO3===Fe(NO3)3+NO↑+2H2O ①
Fe+2Fe3+===3Fe2+ ②
Fe+Cu2+===Fe2++Cu ③
铁粉加至1 mol前是与HNO3反应,由反应①知原溶液中HNO3为4 mol(生成1 mol Fe3+).铁粉从1 mol到2 mol时是与Fe3+反应,消耗2 mol Fe3+,据反应②知原有的Fe(NO3)2为2 mol-1 mol.铁粉从2 mol到3 mol时,由反应③得其中1 mol Fe 消耗Cu2+ 1 mol,所以Fe(NO3)2、Cu(NO3)2、HNO3物质的量浓度之比为1∶1∶4.
答案:D
3.(2009·长春高中毕业班测试)用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否.下列类推结论中正确的是
( )
A.Na失火不能用CO2灭火,K失火不能用CO2灭火
B.工业上电解熔融MgCl2制取金属镁,也用电解熔融AlCl3的方法制取金属铝
C.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
解析:AlCl3为共价化合物,熔融状态不导电,故不能用电解熔解AlCl3的方法制取金属铝;Fe与S直接化合只能生成FeS;Pb3O4中铅的化合价分别为+4价和+2价,故Pb3O4应写成2PbO·PbO2的形式.
答案:A
2.下列离子方程式书写正确的是
( )
A.铝粉投入到NaOH溶液中:
2Al+2OH-===2AlO+H2↑
B.AlCl3溶液中加入足量的氨水:
Al3++3OH-===Al(OH)3↓
C.三氯化铁溶液中加入铁粉:
Fe3++Fe===2Fe2+
D.FeCl2溶液跟Cl2反应:
2Fe2++Cl2===2Fe3++2Cl-
解析:离子反应方程式必须符合反应原理,铝与强碱溶液的反应中,氧化剂是水而不是碱,A错;氨水是弱碱不能写成离子形式,B错;离子方程式必须符合质量(原子个数)守恒和离子总电荷守恒,所以C错.
答案:D
1. 下列物质反应后一定有+3价铁生成的是
( )
①过量的Fe与Cl2反应
②Fe与过量稀H2SO4反应后,再向其中加入KNO3
③Fe和Fe2O3的混合物溶于盐酸中
A.① B.①③
C.①② D.全部
解析:虽然铁粉过量,但铁与Cl2发生反应的产物为FeCl3,故①中有+3价铁生成;Fe与稀H2SO4反应生成FeSO4,当溶液中有H+存在时,NO会将Fe2+氧化生成Fe3+,故②中有+3价铁生成;Fe和Fe2O3的混合物溶于盐酸中时,若铁粉很多,则过量的铁粉与生成的FeCl3发生反应生成FeCl2,而使溶液中无Fe3+,故③中不一定有+3价铁生成,所以选C.
答案:C
22.(9分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O28Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是________(填代号).
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O+2I-===2SO+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.
试用离子方程式表示Fe3+对上述反应催化的过程.
________、________(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为________.
证明炉渣中含有FeO的实验现象为____________________________________.
解析:(1)按照题给化学方程式,氧气中氧的化合价降低,铜的化合价也降低,因此被还原的元素有铜和氧.若按照量的关系,21 mol氧气反应时得到84 mol电子,而铁失去4 mol电子,硫失去96 mol电子,根据得失电子守恒,铜应得到16 mol电子.
(2)要综合考虑二氧化硫的性质和环境保护,高空排放会引起大气污染;二氧化硫可与氧气催化氧化生成三氧化硫,进而与水结合生产硫酸;亚硫酸的酸性比碳酸强,因此可用纯碱来吸收制取Na2SO3;浓硫酸不能氧化二氧化硫,因此不能用浓硫酸吸收二氧化硫.
(3)要考虑常见的氧化剂和还原剂之间的反应,因为Fe3+可以氧化I-生成Fe2+,而亚铁离子可以被过二硫酸钾(K2S2O8)氧化又生成Fe3+,这就是催化的机理.
(4)要考虑氢氧化铝的两性,用过量的氢氧化钠即可除去铝离子;二价铁具有还原性,而高锰酸钾具有氧化性,通过高锰酸钾的颜色变化即可证明FeO的存在.
答案:(1)Cu、O (2)b、c (3)2Fe3++2I-===2Fe2++I2
S2O+2Fe2+===2SO+2Fe3+(离子方程式不配平也可)
(4)a.Al3++4OH-===AlO+2H2O
b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com