
题目列表(包括答案和解析)
2. ( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全对
解析:焰色反应由于是通过观察火焰颜色来检验离子存在的实验,所以实验时所用火焰和所用金属丝在灼烧时都不应该有很明显的颜色,否则将无法观察到被检验离子的真实焰色反应情况.观察钾的火焰颜色时要透过蓝色钴玻璃,目的是为了滤去黄光.
答案:D
1. 下述对焰色反应实验操作注意事项的说明,正确的是
13.下图表示各物质之间的转化关系,其中A、B、C、G为单质.②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀.
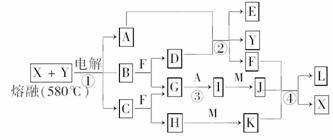
试完成下列有关问题:
(1)M的化学式为________,Y在实验室中的用途有________________(列举一列).
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的:________.工业生产中,还常常利用电解X和F的混合物制取__________________.
(3)反应②的化学方程式是________.
(4)反应④的离子方程式是________.
解析:据“E是一种具有漂白作用的盐,Y易潮解,且②是工业生产中常见反应”,可推断出E为Ca(ClO)2,Y为CaCl2,又因为A为单质,所以A为Cl2,D为Ca(OH)2,再据反应①可判断出B为Ca,F为H2O,G为H2,故I为HCl,因为M为Al2O3或Al(OH)3,则H必然为强碱,因此确定X为NaCl,C为Na,H为NaOH,最后结合反应④知M为Al2O3,J为AlCl3,K为NaAlO2,L为Al(OH)3.
答案:(1)Al2O3 用作干燥剂
(2)降低X、Y熔化时的温度,节约能源 Cl2、H2和NaOH
(3)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO2)+2H2O
(4)Al3++3AlO+6H2O===4Al(OH)3↓
12.某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子,并尽可能减少AlCl3的损失.请回答下列问题:
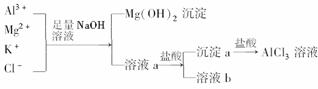
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:________、________、________.氢氧化钠溶液能否用氨水代替,为什么?______________________.
(2)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制溶液的pH,为什么?________;为此,改进方法是____________________.
(3)为了研究AlCl3晶体的性质,在得到AlCl3溶液后,如何得到AlCl3晶体?____________________.
解析:(1)加入足量氢氧化钠溶液,Mg2+可与OH-反应生成Mg(OH)2沉淀,Al3+与OH-反应生成NaAlO2和H2O;氢氧化钠溶液不能用氨水代替,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开;(2)加入氢氧化钠溶液后除去了Mg2+,但又引入了Na+,同时Al3+转化成了AlO;因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀时需要控制溶液的pH,以防止部分Al(OH)3溶解;氢氧化铝只能与强碱或强酸反应,因此,可在溶液a中通入过量二氧化碳气体;(3)直接加热蒸发AlCl3溶液会因为AlCl3水解而得不到AlCl3晶体,为此可在酸性气氛下进行蒸发结晶.
答案:(1)Mg2++2OH-===Mg(OH)2↓
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO+2H2O 不能,因为Al(OH)3不能溶于过量的氨水中,不能将Al(OH)3与Mg(OH)2分开
(2)K+、Cl-、Na+、AlO 因为Al(OH)3能溶于强酸,所以需控制pH,防止部分Al(OH)3溶解 在a溶液中通入过量CO2气体
(3)在酸性气氛中对AlCl3溶液进行蒸发结晶
11.要使含a mol Al3+的A溶液中铝元素和含有b mol AlO的B溶液中铝元素全部转化为Al(OH)3沉淀,有________种途径,Al(OH)3的物质的量为________.(不准加固体试剂和液体试剂)
解析:由于题目中不准使用固体试剂和液体试剂,因此只能用气体.即:
Al3++3NH3·H2O===Al(OH)3↓+3NH ①
2AlO+CO2+3H2O===2Al(OH)3↓+CO ②或
Al3++3AlO+6H2O===4Al(OH)3↓ ③
由上述反应关系可以推测应有如下三种途径:①②;①③;②③;根据Al守恒,无论哪种途径,若结果要使Al元素全部转化为Al(OH)3,其物质的量都是(a+b)mol.
答案:3 (a+b) mol
10.(2009·常州检测)甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是
( )
A.Al2(SO4)3 B.NaOH
C.BaCl2 D.FeSO4
解析:由将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失这一现象可知,丁为NaOH溶液,乙为Al2(SO4)3溶液,BaCl2和FeSO4两物质中与NaOH溶液不反应的是BaCl2溶液,所以丙为FeSO4.
答案:D
9.对某溶液有如下操作:
①向该溶液中加入过量的盐酸生成白色沉淀;②过滤后向滤液中加入过量的氨水(使溶液呈碱性),又有白色沉淀生成;③再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀.原溶液中含有的离子可能是
( )
A.Ag+、Cu2+、Ba2+ B.Ag+、Ba2+、Al3+
C.Ag+、Fe3+、Ca2+ D.Al3+、Mg2+、K+
解析:某溶液依次跟盐酸、氨水、Na2CO3反应都产生白色沉淀,可推知溶液中应有Ag+、Al3+、Ba2+或Ca2+.因此由①可排除D,由②可排除A、C,故选B.
答案:B
0.5 mol 0.5 mol 0.5 mol
则n(AlCl3)∶n(NaOH)=1 mol∶(3+0.5) mol=2∶7
答案:A
8.(2009·潍坊一摸)将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是
( )
①1∶3 ②2∶3 ③1∶4 ④2∶7 ⑤任意比
A.②④ B.只有⑤
C.②③ D.①④
解析:沉淀一定是Al(OH)3,而溶液中的Al元素可以是AlCl3或NaAlO2.若AlCl3过量,则溶液中Al元素的存在形式为Al3+,设Al(OH)3为1 mol,
据AlCl3+3NaOH===Al(OH)3↓+3NaCl
1 mol 3 mol 1 mol
则n(AlCl3)∶n(NaOH)=(1+1)∶3=2∶3.
若AlCl3的量不足,且3<<4,溶液中Al元素的存在形式为AlO.
设AlCl3的物质的量为1 mol.据
AlCl3+3NaOH===Al(OH)3↓+3NaCl
1 mol 3 mol 1mol
Al(OH)3+NaOH===NaAlO2+2H2O
7.(2009·河北郑定中学模拟)A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图所示的转化关系(部分产物及反应条件已略去),下列判断正确的是
( )
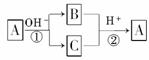
A.X元素可能为Al
B.X元素可能是金属,也可能是非金属
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
解析:A为单质,B、C为化合物,所以①、②一定为氧化还原反应,所以D正确;据这两个反应特点知A元素在①反应中化合价既升高,又降低,故A一定不是金属,A、B错误;①②不互为可逆反应,因为条件不同.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com