
题目列表(包括答案和解析)
7.若1.8 g某金属跟足量盐酸充分反应,放出2.24 L(标准状况)氢气,则该金属是( )
A.Al B.Mg C.Fe D.Zn
解析:设金属的摩尔质量为M,化合价为n,根据得失电子守恒有×n=×2,=9 g/mol,所以该金属为Al.
答案:A
6.(2009·广东一摸)把一小块金属钠放入下列溶液中,既能产生气体又会出现白色沉淀的是
( )
A.稀硫酸 B.氢氧化钾稀溶液
C.硫酸铜溶液 D.氯化镁溶液
解析:Cu(OH)2是蓝色沉淀.钠和MgCl2溶液反应先和水反应,生成NaOH,再与Mg2+反应生成Mg(OH)2白色沉淀.
答案:D
5.某化学兴趣小组用回收的镁铝合金制取氢气.现有10.8 g镁铝合金,下列说法正确的是
( )
A.常温下与足量18 mol/L H2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2 mol/L HNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0.45-0.6 mol之间
D.常温下与足量2 mol/L NaOH溶液反应,放出H2的物质的量在0.45-0.6 mol之间
解析:浓硫酸和硝酸与镁、铝反应都不生成氢气,排除A、B项. 铝与氢氧化钠反应产生氢气,而镁不能与氢氧化钠反应,排除D项.若10.8 g全为Mg的质量,则n(Mg)=10.8 g÷24 g/mol=0.45 mol,Mg+2H+===Mg2++H2↑,n(H2)=0.45 mol;若10.8 g全为Al的质量,则2Al+6H+===2Al3++3H2↑,n(Al)=10.8 g÷27 g/mol=0.4 mol,n(H2)=0.6 mol,根据平均值原理,0.45 mol<n(H2)<0.6 mol.
答案:C
4.下列关于铁的叙述正确的是
( )
①铁能被磁铁吸引,但纯铁易被腐蚀
②在人体内的血红蛋白中含有铁元素
③铁位于元素周期表中第四周期第ⅢB族
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3
⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②④ C.②⑤ D.④⑥
解析:①纯铁不易腐蚀;③铁位于第四周期第Ⅷ族;⑤铁过量时与硝酸反应生成Fe(NO3)2;⑥FeCl2可由Fe和FeCl3,Fe(OH)3可由Fe(OH)2、O2、H2O化合而成.
答案:B
3.m g Na与足量Cl2反应,生成固体的质量为(m+3.55) g,则等量Na与O2反应,生成固体的质量可能为
( )
①(m+0.8)g ②(m+1.1) g
③(m+1.4) g ④(m+1.6) g
A.① B.④
C.②③ D.都有可能
解析:钠与Cl2反应生成NaCl,由此可知钠为0.1 mol,而Na与O2反应可以生成Na2O或Na2O2,则此增加的质量介于0.8 g和1.6 g之间,最后生成的固体质量都有可能,选D.
答案:D
2.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁,如图,将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是
( )
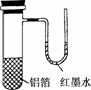
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝与氧化汞的混合物
解析:本题中涉及的反应有:2Al+3Hg(NO3)2===2Al(NO3)3+3Hg,4Al+3O2===2Al2O3,两个反应均为氧化还原反应;由题中所述现象“红墨水柱右端上升”,可推知试管中气体体积受热膨胀,意味着铝与氧气反应是放热反应;铝片上生成的“白毛”是氧化铝.
答案:D
1.(2009·潍坊高三统一考试)南极考察队在印度洋发现了一种不寻常的鱼,它的血液像水一样无色透明.研究发现这种鱼的血液中某种元素的含量是其他鱼血液中的十分之一. 这种元素是
( )
A.Cu B.Ag C.Fe D.Pb
解析:血液呈现红色主要是血红蛋白造成的,血红蛋白中必然含有铁,无色透明就是几乎无血红蛋白.
答案:C
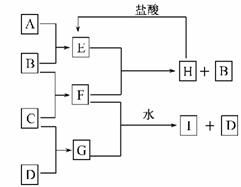
13.A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色. 在G中,非金属元素与金属元素的原子个数比为1∶2.在一定条件下,各物质之间的相互转化关系如图所示(图中部分产物未列出):
请填写下列空白:
(1)A是________,C是________.
(2)H与盐酸反应生成E的化学方程式是________________________________.
(3)E与F反应的化学方程式是________________.
(4)F与G的水溶液反应生成I和D的离子方程式是__________________________.
解析:本题为无机框图题,主要考查Na2O2及氧化还原反应的知识,单质B是组成空气的成分(O2或N2),而化合物F是由B、C两元素组成的化合物,F的焰色反应为黄色,故C为Na.化合物G是由C(Na)和D组成,且金属(Na)与非金属元素(D)的原子个数比为2∶1,即非金属D在化合物G中显-2价,根据D为第三周期元素可知,D为S,亦即G为Na2S.
G(Na2S)+FI+D(S),该反应为氧化还原反应,化合物F能将S2-氧化成S,故F具有强氧化性,而F的组成元素为钠和氧,所以F为Na2O2.空气的成分之一E能与Na2O2反应放出O2,结合H与盐酸反应可得到E,故E为CO2,A为碳.
答案:(1)碳(或C) 钠(或Na)
(2)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(3)2CO2+2Na2O2===2Na2CO3+O2
(4)Na2O2+S2-+2H2O===4OH-+S↓+2Na+
12.用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.

(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:a.有氧气生成;b.________.
(2)写出Na2O2和H2O反应的化学方程式并标明电子转移数目:_____________________.
(3)某学校研究性学习小组拟用右图所示装置进行实验,以证明上述结论.
①用以验证结论a的实验操作方法及现象是________________________.
②用以验证结论b的实验操作方法及现象是________________________.
(4)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,请你设计一个简单的实验以证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在.(只要求列出实验所用的试剂及观察到的现象)
试剂:______________________________.
现象:______________________________.
解析:(1)脱脂棉剧烈燃烧,说明该反应放热.
(2)注意该反应中Na2O2既是氧化剂,又是还原剂.
(3)证明有O2生成的方法是将带火星的小木条靠近导管口p处,木条复燃.证明反应放热可将导管q放入水槽中,反应过程中有气泡冒出.
(4)利用H2O2具有强氧化性,可将Na2S氧化而产生沉淀或使有色布条褪色.
答案:(1)该反应是放热反应

(3)①将带火星的木条靠近导管口p处,木条复燃
②将导管q放入木槽中,反应过程中有气泡冒出
(4)Na2S溶液 溶液变浑浊(有淡黄色沉淀生成)
(有色布条,布条褪色等合理答案均可)
11.称取一定质量的纯碱,溶于水中,与适量的盐酸作用,根据下列情况填写盐酸的用量和气体的量的变化.
(1)若纯碱中混有K2CO3,盐酸的用量将________,生成CO2气体的量________.
(2)若纯碱中混有NaHCO3,盐酸的用量将________,生成CO2气体的量________.
(3)若纯碱中混有NaCl,盐酸的用量将________,生成CO2气体的量________.
(4)若纯碱中混有NaOH,盐酸的用量将________,生成CO2气体的量________.
解析:Na2CO3+2HCl===2NaCl+CO2↑+H2O
mol mol mol
K2CO3+2HCl===2KCl+CO2↑+H2O
mol mol mol
NaHCO3+HCl===NaCl+CO2↑+H2O
mol mol mol
NaOH+HCl===NaCl+H2O
mol mol
因此,(1)若混有K2CO3,则耗HCl减少,产生的CO2也减少.
(2)若混有NaHCO3,则耗HCl减少,产生的CO2增多.
(3)若混有NaCl,则耗HCl减少,产生的CO2减少.
(4)若混有NaOH,则耗HCl增多,产生的CO2减少.
答案:(1)减少 减少 (2)减少 增多 (3)减少 减少 (4)增多 减少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com