
题目列表(包括答案和解析)
4.(2009·广州惠州调研)石墨与金刚石都是碳的单质,工业上常用石墨在一定条件下转化为金刚石的反应原理生产人造钻石.已知12 g石墨完全转化成金刚石时需要吸收E kJ的能量.则下列说法正确的是
( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
D.等质量的石墨和金刚石完全燃烧,石墨放出的能量多
解析:石墨完全转化成金刚石时需要吸收能量,说明石墨的能量比金刚石低,故石墨比金刚石稳定,B对;由于金刚石的能量比石墨高,故等质量的石墨和金刚石完全燃烧,金刚石放出的能量多,C对.
答案:BC
3.已知下列反应的热化学方程式为 :
(1)C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
(2)CH3COOH(l)+2O2(g)―→2CO2(g)+2H2O(l)
ΔH2=-870.3 kJ/mol
(3)H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热(焓变)为
( )
A.488.3 kJ/mol B.-488.3 kJ/mol
C.-244.15kJ/mol D.244.15kJ/mol
解析:据盖斯定律知(1)×2+(3)×2-(2)即得
2C(s)+2H2(g)+O2(g)===CH3COOH(l)
方程式的反应热
ΔH=(-393.5 kJ/mol)×2+(-285.8 kJ/mol)×2-(-870.3 kJ/mol)=-488.3 kJ/mol
答案:B
2.下列反应中生成物总能量高于反应物总能量的是
( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝与氧化铁粉末反应
D.氧化钙溶于水
解析:生成物总能量高于反应物总能量,说明反应是吸热的;乙醇燃烧、铝热反应、氧化钙与水的反应都是放热的.
答案:A
1.合理利用燃料减小污染符合“绿色奥运”理念,下列关于燃料的说法正确的是
( )
A.“可燃冰”是将水变为油的新型燃料
B.氢气是具有热值高、无污染等优点的燃料
C.乙醇是比汽油更环保、不可再生的燃料
D.石油和煤是工厂经常使用的可再生的化石燃料
解析:A项,不符合化学反应原理;C项,乙醇是可再生燃料;D项,石油和煤是不可再生燃料,只有B项正确.
答案:B
13. 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+.
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示).
(2)写锌与强碱反应的化学方程式:______________________________________.
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________.
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式:____________________.试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:_________________________.
解析:铝、锌性质相似,考查学生在灵活应用铝的性质基础上的知识迁移能力.由于课本上学习了Al和NaOH溶液反应的方程式,可得出(1)的答案为AlO;利用Al与碱反应,推导出Zn+2NaOH===Na2ZnO2+H2↑;利用题干信息,Al(OH)3和Zn(OH)2性质的差异,可判定①③④滴加顺序不同,现象也不一样;而②不论怎样滴加,现象只有一个,即产生白色沉淀;(4)中只要把握好氨水是弱碱,在离子反应中写成分子式,就能准确写出正确的离子方程式.又因Zn(OH)2能溶于过量氨水,不易控制氨水的用量,故不适宜在实验室用可溶性锌盐与氨水反应制取Zn(OH)2.
答案:(1)AlO
(2)Zn+2NaOH===Na2ZnO2+H2↑
(3)①③④
(4)Al3++3NH3·H2O===Al(OH)3↓+3NH 可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中生成[Zn(NH3)4]2+,氨水的用量不易控制
12.(2009·枣庄质检)金属钠与水的反应是中学化学中的一个重要反应.高一化学教材中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:
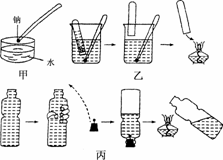
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中加入一小块金属钠.下列现象描述正确的是________(填字母).
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C. 反应开始后,溶液由无色变红色
D.恢复到室温时,水槽底部有固体物质析出
(2)请补充并完成甲实验从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠―→____________________________________―→用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的水槽中.
(3)某同学用镊子夹住一块钠,按图乙所示方法来收集产生的气体,但钠很快脱落,实验没有成功. 正确的关键操作应为______________________.
(4)用装满水的矿泉水瓶按图丙所示方法进行实验,用手挤压矿泉水瓶并塞紧带有钠的塞子,共排出水的体积为16.8 mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均属于标准状况,则所用的钠的质量为________g.
解析:(1)钠投入到Ca(HCO3)2溶液中,钠熔化成光亮的小球,浮在水面上,并四处游动,最后消失.反应生成的NaOH与Ca(HCO3)2发生反应而产生CaCO3沉淀.
(2)取用钠的操作:用镊子从试剂瓶中取出一小块钠,用滤纸吸干表面的煤油,在玻璃片上用小刀切下一块绿豆大小的钠粒,多余的钠要放回试剂瓶中.
(3)应用铝箔包住钠块,然后用针在铝箔上刺几个孔,再用镊子夹住.
(4)n(Na)=2n(H2)=2×=0.0015 mol,
m(Na)=0.0015 mol×23 g/mol=0.0345 g
答案:(1)ABD
(2)用滤纸吸干表面的煤油,在玻璃片上用小刀切下一块绿豆大小的钠粒,并将多余的钠放回试剂瓶中
(3)用铝箔包好钠块,然后用针在铝箔上刺几个孔,再用镊子夹住
(4)0.0345
11.(2010·海南三亚模拟)等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的生成物中,该金属元素的化合价为
( )
A.+1 B.+2 C.+3 D.+4
解析:金属与酸反应生成氢气的关系:R-H2(n为生成物中金属的化合价),由题给条件:VB=2VC,且VA+VB=VC,则VA=3VC.由3种金属物质的量相等,则A、C两金属在生成物中的化合价之比为3∶1,又由于是主族金属,A只能为+3价,C为+1价,所以本题的正确选项为A.
答案:A
10.实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法:
铝片澄清溶液饱和NH4HCO3溶液过滤、洗涤白色
沉淀稀HNO3溶解、蒸发、结晶Al(NO3)3·9H2O
下列说法或反映上述有关反应的离子方程式错误的是
( )
A.制备过程中加HNO3应该过量,以防止蒸发时Al(NO3)3水解
B.不直接用铝片跟稀硝酸反应制硝酸铝主要是因为铝在稀硝酸中发生钝化
C.2Al+2OH-+2H2O===2AlO+3H2↑
D.3H++Al(OH)3===Al3++3H2O
解析:铝片溶于NaOH溶液时发生的反应为2Al+2OH-+2H2O===2AlO+3H2↑,向所得澄清溶液(NaAlO2)中加入饱和NH4HCO3溶液时,一方面会发生双水解反应AlO+NH+H2O===Al(OH)3↓+NH3↑,另一方面发生反应AlO+HCO+H2O===Al(OH)3↓+CO,产生的白色沉淀都是Al(OH)3,最后加入过量的硝酸将它溶解得到硝酸铝溶液,过量的硝酸能抑制Al3+的水解反应.如果直接将铝溶解在稀硝酸中,会产生有毒的NO气体,对环境产生污染.浓硝酸可以使铝发生钝化,稀硝酸不可以.
答案:B
9.下列说法正确的是
( )
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东正在打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
解析:本题考查了金属的性质及应用.不锈钢中除含有金属元素外,还含有C等非金属元素;硬币的材质是合金;铝由于活泼性强,是近代才开发使用的金属,在明代不可能存在;合金的硬度、强度高于组成合金的各成分金属,故只有D正确.
答案:D
8.下列有关纯铁的描述中正确的是
( )
A.熔点比生铁低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
解析:生铁中含有碳等杂质,属于铁的合金,合金的熔点比纯金属低,A选项不正确;在与盐酸反应时,生铁中由于含碳,构成原电池,加快了反应,B选项不正确;在潮湿空气中也是生铁更容易被腐蚀,C选项也不正确;只有D选项符合题意.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com