
题目列表(包括答案和解析)
2.(2010·莆田模拟)下列关于浓硫酸与稀硫酸的说法,不正确的是( )
A.浓硫酸有脱水性,稀硫酸没有脱水性
B.浓硫酸有氧化性,稀硫酸没有氧化性
C.浓硫酸和稀硫酸都有酸性
D.常温下,浓硫酸和稀硫酸都不能与铜反应
解析:浓H2SO4有氧化性,稀H2SO4也有氧化性,只不过浓H2SO4的氧化性是由+6价S体现出来,而稀H2SO4的氧化性是由+1价的H体现出来.
答案:B

[基础等级评价]
1.(2010·重庆高考)减缓温室气体排放是2009年哥本哈根气候变化会议的议题.下列反应不产生温室气体的是( )
A.用纯碱制玻璃 B.用煤炭作燃料
C.用铁矿石炼铁 D.用氨制碳酸铵
解析:二氧化碳是温室气体.制玻璃时,碳酸钠与二氧化硅高温反应生成二氧化碳;煤燃烧、用铁矿石炼铁时都有二氧化碳生成;用氨制备碳酸铵则以二氧化碳为原料,不产生二氧化碳.
答案:D
22.(10分)(2010·莆田模拟)某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置..
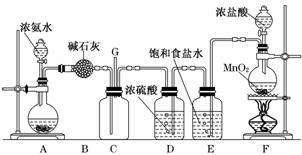
请回答下列问题:
(1)装置F中发生反应的离子方程式为_____________________________________
________________________________________________________________________;
(2)B装置的名称是__________________________________________________________;
(3)E装置的作用____________________________________________________________;
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:_________________________________________________________;
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?_______________________________________________ _________________________.
_________________________.
解析:F、E、D是制取纯净干燥Cl2的装置,E吸收Cl2中的HCl气体,D干燥Cl2,B的作用是干燥NH3.(4)C中的白烟是NH4Cl,另一产物则是N2.(5)黄绿色气体为Cl2,需用碱液吸收.
答案:(1)4H++2Cl-+MnO2△Mn2++Cl2↑+2H2O
(2)干燥管 (3)除去氯气中的氯化氢
(4)3Cl2+8NH3===N2+6NH4Cl
(5)在G处连接导管,直接把尾气通入盛有烧碱溶液的烧杯中.
21.(8分)下图是几种中学常见的物质之间的转化关系,氧化物A是光导纤维的主要原料,Ⅰ、Ⅲ为非金属单质、Ⅱ为主族元素的金属单质.
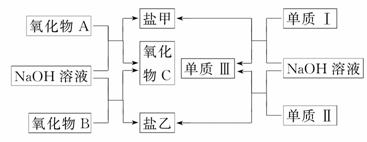
(1)氧化物A的化学式为________,写出氧化物A与NaOH溶液反应的化学方程式________________________________________________________________________
________________________________________________________________________;
(2)向盐乙的水溶液中通入过量CO2,发生反应的离子方程式为____________________,向乙溶液中逐渐加入氯水能看到的实验现象为____________________.
(3)单质Ⅰ的用途非常广泛,如用作________(只需写一种);工业上制备单质Ⅰ的化学方程式为________________________________________________________________________
________________________________________________________________________.
解析:由已知得:A为SiO2,SiO2与NaOH反应生成盐甲(Na2SiO3)和氧化物C(H2O).在中学范围内常见的能与NaOH反应的非金属单质为Si,金属单质为Al,故单质Ⅰ为Si,与NaOH溶液反应生成Na2SiO3和单质Ⅲ(H2):Si+2NaOH+H2O===Na2SiO3+2H2↑,单质Ⅱ为Al,与NaOH反应生成盐乙(NaAlO2)和H2:2Al+2NaOH+2H2O===NaAlO2+3H2↑,推知氧化物B为Al2O3.因氯水中含有盐酸,所以氯水中逐渐加入NaAlO2溶液时首先生成白色沉淀,随着氯水的加入沉淀逐渐溶解.由于H2CO3的酸性大于Al(OH)3,向NaAlO2溶液中通入过量的CO2时,会生成白色沉淀Al(OH)3,其离子反应为:AlO+CO2+2H2O===Al(OH)3↓+HCO.工业上是利用SiO2在高温下与C反应来制备Si:SiO2+2C高温Si+2CO↑.
答案:(1)SiO2 SiO2+2NaOH===Na2SiO3+H2O
(2)AlO+CO2+2H2O===Al(OH)3↓+HCO 产生白色沉淀,然后沉淀逐渐溶解至消失
(3)半导体材料(其他合理答案也可) SiO2+2C高温Si+2CO↑
20.(10分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
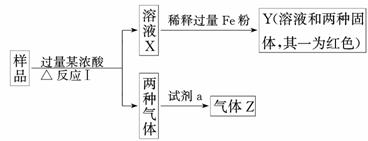
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成.取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)________.
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是_________________________________________________________________
________________________________________________________________________.
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是________________________________________________________________________.
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________________________________________________________________________.
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I-时,共转移3 mol 电子,该反应的离子方程式是________________________________________________________________________
________________________________________________________________________.
(5)另取原样品,加入足量稀硫酸反应.若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)____________________.
解 析:由题干中框图转化的关系可知,Y中必含Cu,另有Fe2+.
析:由题干中框图转化的关系可知,Y中必含Cu,另有Fe2+.
(1)上层清液中通入CO2无明显现象说明无AlO,进一步说明样品中无Al.
(2)①Z为一种气体,则必为CO2,说明另一种气体为SO2被NaHCO3溶液除去,浓酸为浓H2SO4,反应为:
C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O
②Z为两种气体,a为H2O,则说明浓酸为浓HNO3,Z中气体为NO和CO2.
( 3)Cl2+2Fe2+===2Cl-+2Fe3+,2Fe3++Cu===2Fe2++Cu2+循环反应,则溶液中阳离子为Fe3+、Cu2+和过量酸余下的H+.
3)Cl2+2Fe2+===2Cl-+2Fe3+,2Fe3++Cu===2Fe2++Cu2+循环反应,则溶液中阳离子为Fe3+、Cu2+和过量酸余下的H+.
(4)据题目信息可推知氧化还原反应为:
4I-+3H2O2+2Fe2+===2I2+2Fe(OH)3↓
(5)由题意分析无Cu生成,则必定是不发生Cu2++Fe===Cu+Fe2+或2Al+3Cu2+===3Cu+2Al3+的置换反应,说明混合物中无Fe和Al.由题干框图知必含CuO和C.则组合可能为CuO、C;CuO、C、Fe2O3.
答案:(1)Al (2)①C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O ②NO、CO2
(3)Cu2+、Fe3+、H+
(4)2Fe3++3H2O2+4I-===2Fe(OH)3↓+2I2
(5)CuO、C CuO、C、Fe2O3
19.(8分)化合物A是一种重要的光化学试剂,属不含结晶水的盐.A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
已知:A中含两种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3.阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍.C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色.回答下列问题:
(1)A的化学式______________________________________________________________.
(2)D+E→C+G的方程式__________________________________________________.
(3)H+H2O2→I的离子反应方程式___________________________________________.
(4)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色.产生上述现象的主要原因是__________________________.
解析:A中含两种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3,则A中二种阳离子的价态分别是+1和+3,阴离子 的价态是-2.C能使澄清石灰水变浑,C是二氧化碳.D是一氧化碳.E是一种红棕色的颜料,E是Fe2O3,
F的焰色反应呈紫色,说明B中有K元素,A是K3Fe(C2O4)3 而不是K3Fe(CO3)3.
的价态是-2.C能使澄清石灰水变浑,C是二氧化碳.D是一氧化碳.E是一种红棕色的颜料,E是Fe2O3,
F的焰色反应呈紫色,说明B中有K元素,A是K3Fe(C2O4)3 而不是K3Fe(CO3)3.
答案:(1)K3Fe(C2O4)3
(2)3CO+Fe2O3高温2Fe+3CO2
(3)2Fe2++H2O2+2H+===2Fe3++2H2O
(4)因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴 加KSCN溶液,Fe3+与SCN-结合形成红色溶液.
加KSCN溶液,Fe3+与SCN-结合形成红色溶液.
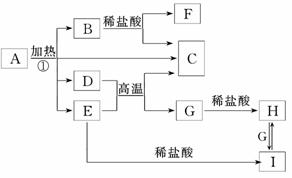
18.(8分)(2010·德州模拟)A-J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素,D为棕黄色溶液,E为白色絮状沉淀.请填写下列空白:
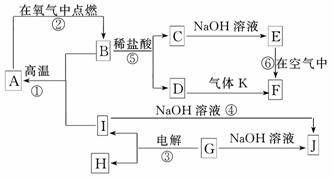
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中的位置________________________________________________________________________.
(2)写出检验 D溶液中阳离子的方法_________________________________________.
D溶液中阳离子的方法_________________________________________.
(3)写出反应④的离子方程式________________________________________________.
(4)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所 得溶液的pH________7(“>”、“<”或“=”),用离子方程式表示其原因:________________;若向气体K的0.1 mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中含各离子物质的质量浓度由大到小的
得溶液的pH________7(“>”、“<”或“=”),用离子方程式表示其原因:________________;若向气体K的0.1 mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中含各离子物质的质量浓度由大到小的 关系是________________________________________________________________________.
关系是________________________________________________________________________.
解析:由“电解NaOH”及题干知G为Al2O3,则J NaAlO2,I为Al,H为O2;E(白色絮状沉淀)在空气中F,可知E为Fe(OH)2,F为Fe(OH)3逆推可得C为FeCl2,D为FeCl3,K为NH3,B为Fe3O4,A为Fe.(4)反应后溶质为NH4Cl,NH水解使溶液显酸性;加入等体积pH=1的H2SO4,反应生成(NH4)2SO4,离子浓度大小关系为:c(NH)>c(SO)>c(H+)>c(OH-).
答案:(1)第4周期、第Ⅷ族
(2)取少许D溶液于试管中,滴加KSCN溶液,溶液变红色,证明D溶液中含有Fe3+
(3)2Al+2OH-+2H2O===2AlO+3H2↑
(4)< NH+H2O NH3·H2O+H+
NH3·H2O+H+
c(NH)>c(SO)>c(H+)>c(OH-)
17.(8分)实验室 可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
|
方 案 |
|
①Al―→Al3+―→Al(OH)3 |
②Al ―→AlO―→Al(OH)3 ―→AlO―→Al(OH)3 |
 |
(1)用方案①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,写出该方案中有关的离子方程式:______ ________________________________________________________.
________________________________________________________.
(2)用方案②来制备Al(OH)3时,必须注意________________的用量, 以防止生成的Al(OH)3溶解.
(3)完成下表
|
方案 |
生成1mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
|
消耗H+ |
消耗OH- |
|
|
① |
3 |
|
|
② |
|
1 |
|
③ |
3/4 |
|
(4)三种方案中,你认为最好的是________(填序号),原因是________________________________________________________________________.
解析:(1)铝屑和稀硫酸反应生成硫酸铝和氢气,硫酸铝和氨水反应生成氢氧化铝和硫酸铵.
(2)稀硫酸过量,导致氢氧化铝溶解.
(3)(4)只要写出化学方程式,就能得出结论.
答案:(1)2Al+6H+===2Al3++3H2↑;
Al3++3NH3·H2O===Al(OH)3↓+3NH
(2)稀硫酸
(3)
|
方案 |
生成1mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
|
消耗H+ |
消耗OH- |
|
|
|
|
|
|
① |
|
3 |
|
② |
1 |
|
|
③ |
|
3/4 |
(4)③ 药品用量最少
16.有一瓶无色溶液,可能含有K+、Al3+、Mg2+、NH、Cl -、SO、HCO、MnO离子中的几种.为确定其成分,做如下实验:
①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.
下列推断正确的( )
A.肯定有Al3+、Mg2+、NH、Cl-
B.可能有Al3+、Mg2+、HCO
C.肯定无NH、 MnO、SO
D.肯定有Al3+、Mg2+、SO
解析:MnO为紫色,肯定不存在;①加入适量Na2O2固 体,产生无色无味的气体,说明不含NH,再加入足量的NaOH溶液后白色沉淀部分溶解,说明一定有Al3+、Mg2+,Al3+与HCO不共存,故不含HCO,②说明一定含SO.故一定含有的离子为:Al3+、Mg2+、 SO.
体,产生无色无味的气体,说明不含NH,再加入足量的NaOH溶液后白色沉淀部分溶解,说明一定有Al3+、Mg2+,Al3+与HCO不共存,故不含HCO,②说明一定含SO.故一定含有的离子为:Al3+、Mg2+、 SO.
答案:D
15.下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4 ③HCl NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③
C.①③④ D.①②④
解析:KOH与AlCl3互滴产生不同现象,而Na2SO4与二者均不反应,①可鉴别;NaHCO3与H2SO4混合有气体生成,与 Ba(OH)2混合有白色沉淀生成,②可鉴别;HCl、NaHSO4与NaAlO2互滴产生现象相同,不能区别HCl和NaHSO4;Na2CO3与Ca(OH)2、BaCl2混合均有白色沉淀生成,不能区别Ca(OH)2与BaCl2.
Ba(OH)2混合有白色沉淀生成,②可鉴别;HCl、NaHSO4与NaAlO2互滴产生现象相同,不能区别HCl和NaHSO4;Na2CO3与Ca(OH)2、BaCl2混合均有白色沉淀生成,不能区别Ca(OH)2与BaCl2.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com