
题目列表(包括答案和解析)
3.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01 NA
B.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
C.标准状况下,22.4 L氯气与足量NaOH溶液反应转移的电子数为2 NA
D.1 mol乙烷分子含有8 NA个共价键
解析:NaClO水解呈碱性,即NaClO溶液中OH-全部由水电离产生,故A项正确;标准状况下,甲醇呈液态,故B项错误;C项中转移的电子数应为NA,C项错误;D项中应为7 NA.
答案:A
2.下列有关比较中,大小顺序排列错误的是( )
A.热稳定性:HF>H2O>H2S
B.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
C.酸性:H4SiO4<H3PO4<H2SO4<HClO4
D.沸点:SiC>NaCl>Si>I2
解析:非金属性越强,氢化物越稳定,最高价含氧酸的酸性越强,故A、C项正确;B项显然正确;D项正确的顺序应为:SiC>Si>NaCl>I2.
答案:D
1.生活中的许多问题常涉及到化学知识.下列有关叙述不正确的是( )
A.次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌,自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害的物质
B.人们应用原电池原理,制作了多种电池,如干电池、充电电池、高能电池等.电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害,所以废旧电池必须回收再利用
C.明矾常作净水剂,但人体摄入大量铝易患”老年性痴呆症”,所以明矾不能大量使用
D.氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的致冷剂.但它能破坏臭氧层,人们正在采取措施减少并逐步停止氟氯烃的生产和使用
解析:臭氧杀菌消毒效果要比氯气好,因为不会残留有毒、有害的物质,氯气消毒后会产生含氯有机物等有毒、有害的物质.
答案:A
(二)猜想:可能含有Fe3+
丙:在加热除去NO2的工业硝酸中加入KSCN溶液 溶液呈红色
(1)4NO2+O2+2H2O===4HNO3
(2)加水将工业硝酸稀释,若有其他杂质颜色也可能变浅接近无色
(二)[提出问题] 上述实验后,溶液还是浅黄色,它还含有什么物质呢?乙、丙两同学提出如下猜想.
[猜想] ____________________.
[设计实验]
|
|
实验步骤 |
现象 |
结论 |
|
乙 |
在除去NO2的工业硝酸中,缓缓加入足量NaOH固体 |
红褐色沉淀生成 |
猜想正确 |
|
丙 |
|
|
[交流讨论]
(1)在(一)中,丙同学实验的原理是:__________________(用化学方程式表示).
(2)甲同学实验得出错误结论的原因可能是_____________________________________
________________________________________________________________________.
解析:在(一)中,甲同学的结论不正确.因为加水将工业硝酸稀释,若含有其他杂质颜色也可能变浅甚至接近无色.乙同学操作后,有红棕色气体逸出,同时溶液颜色变浅,说明NO2溶于硝酸中,但颜色不能完全消失,说明硝酸中还含有其他杂质,呈黄色可猜想为Fe3+.在(二)中,乙同学操作后有红褐色沉淀生成,证明工业硝酸中含有Fe3+,检验Fe3+用KSCN溶液.
答案:(一)呈黄色的工业硝酸中存在NO2气体,但还有其他呈黄色的杂质
(一)[猜想] 工业硝酸呈黄色是由于NO2溶于浓硝酸引起的.
[设计实验] 甲、乙、丙三位同学各在一支洁净试管中倒入约2 mL工业硝酸,进行如下实验:
|
|
实验步骤 |
现象 |
结论 |
|
甲 |
加入5 mL的蒸馏水,振荡使之充分混合 |
试管中的硝酸接近于无色 |
硝酸中没有其他杂质,猜想正确 |
|
乙 |
置于酒精灯上小火加热(在通风橱中进行) |
有红棕色气体逸出,继续加热,直到不再有红棕色气体逸出为止.溶液的黄色变浅,但不能完全消失 |
|
|
丙 |
通入氧气 |
通入足量氧气后,溶液的黄色变浅 |
11.(12分)(2010·山西师大附中模拟)已知多种重金属化合物能催化H2O2的分解反应.试管中加入过量浓氨水并滴入2 mL 5%的AgNO3溶液;A为胶头滴管,预先吸有25%的H2O2溶液;B中装有铂石棉催化剂.点燃酒精灯一段时间后,将A中的H2O2溶液慢慢地滴入试管,试管内产生大量气体.不久,锥形瓶C内出现红棕色气体.回答下列问题:
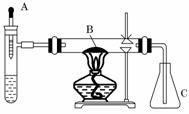
(1)你认为反应中能催化分解H2O2的物质是(写化学式)________.
(2)试管中产生的气体是________.
(3)B中发生反应的化学方程式_________________________________________________
________________________________________________________________________.
(4)本实验还可以改用其他药品,例如在试管中加固体________,胶头滴管预先吸入液体____________.
(5)除干燥装置外,此实验装置的缺点是还缺少______装置.
解析:多种重金属化合物都能催化H2O2的分解.AgNO3与过量氨水发生反应:Ag++NH3·H2O===AgOH↓+NH,
AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O,
所以能催化分解H2O2的物质是[Ag(NH3)2]+,也可写成 [Ag(NH3)2]OH或[Ag(NH3)2]NO3.
[Ag(NH3)2]OH或[Ag(NH3)2]NO3.
答案:(1)[Ag(NH3)2]+或[Ag(NH3)2]OH或
[Ag(NH3)2]NO3
(2)O2、NH3
(3)4NH3+5O2Pt△4NO+6H2O
(4)Na2O2 浓氨水
(5)尾气吸收
12.(15分)(2010·全国卷Ⅱ)A、B、C、D、E、F、G、H和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白色烟雾;
③B和E都能使品红溶液褪色;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A.
回答下列问题:
(1)A的化学式是________,②中烟雾的化学式是________;
(2)④中发生反应的化学方程式是_____________________________________________;
(3)⑤中发生反应的化学方程式是__________________________________ ___________;
___________;
(4)C的化学式是________,D的化学式是________;
(5)⑦中发生反应的化学方程式是_____________________________________________;
(6)H的化学式是________.
解析:根据I气体可以使湿润的红色石蕊试纸变蓝色,可以确定I是NH3;根据I与A相遇可以产生白烟,确定A 是HCl;B、E具有漂白性,可推测为Cl2和SO2,其中B与铜丝反应有棕黄色的烟生成,确定B是Cl2,E是SO2;镁条在F中燃烧有白色固体和黑色固体生成,确定是CO2与Mg的反应,则F是CO2;C和D相遇有红棕色气体生成,说明C和D可能是O2和NO,G在D
是HCl;B、E具有漂白性,可推测为Cl2和SO2,其中B与铜丝反应有棕黄色的烟生成,确定B是Cl2,E是SO2;镁条在F中燃烧有白色固体和黑色固体生成,确定是CO2与Mg的反应,则F是CO2;C和D相遇有红棕色气体生成,说明C和D可能是O2和NO,G在D 中燃烧生成SO2(E)和H2O,根据质量守恒定律可以确定G为H2S,D为O2,则C是NO;再根据B(Cl2)与H混合,有油状液滴和A(HCl)生成,确定H是CH4(或其他烃等).
中燃烧生成SO2(E)和H2O,根据质量守恒定律可以确定G为H2S,D为O2,则C是NO;再根据B(Cl2)与H混合,有油状液滴和A(HCl)生成,确定H是CH4(或其他烃等).
答案:(1)HCl NH4Cl
(2)Cu+Cl2CuCl2
(3)2Mg+CO22MgO+C
(4)NO O2
(5)2H2S+3O22H2O+2SO2
(6) CH4
13.(12分)绿色化学是化学实验永恒追求的目标.某研究性学习小组利用试管等仪器创新设计一组“套管实验”装置,完成中学化学教材中一组实验,实现实验绿色化.
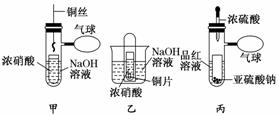
(1)甲装置中铜丝可以上下抽动,甲装置与乙装置相比,优点是_____________________.
(2)乙装置在实验过程中观察到大试管里液面上升,简述原因:______________________
___________________________________________________ _____________________.
_____________________.
(3)实验时,可以观察到丙装置的现象为______________________________________,若微热反应后的溶液,又观察到现象是__________________________________________.
(4)利用丙装置能完成多个实验.下列实验不能利用丙装置完成的是________.
A.证明氨气使酚酞试 液变红
液变红
B.氯的非金属性比碘的强(常温下,氯酸钾与浓盐酸反应生成氯气)
C.乙炔能与溴的四氯化碳溶液反应
D.蔗糖与浓硫酸反应产生二氧化碳
解析:(1)甲装置有类似启普发生器的作用,随时开始反应,随时停止反应,而且药品用量少,节约成本;(2)由于4NO2+O2+2H2O===4HNO3和4NO+3O2+2H2O===4HNO3,生成的HNO3被NaOH溶液吸收,大试管中的气压减小,外界大气压将溶液压入大试管中;(4)浓硫酸与蔗糖反应产生CO2的同时还有SO2产生,无法利用丙装置鉴别CO2.
答案:(1)能随制随停,便于控制反应,节省药品
(2)NO、NO2气体与空气中O2反应,生成的HNO3被氢氧化钠溶液吸收,大试管内气压减小,外界大气压将溶液压入大试管
(3)小试管里产生气泡,固体物质渐渐溶解,品红溶液褪色或变浅,气球鼓起 无色溶液变红色,气球鼓起
(4)D
14.(11分)未来的交通工具将采用由新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是化合物G.
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y.G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体.请推断:①化合物G的化学式为____________.
②由1 mol NH3和0.75 mol E恰好完全反应,化合物E的分子式为________.
(2)粉末状G能够分别与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃、水泥、陶瓷的主要原料.G与氧气反应所得的另一种产物是一种单质,G与水反应生成另一种产物是该种单质元素的氢化物.请写出化合物G与水反应的化学方程式:________________________________.
(3)为了使化合物G能成为新一代汽车发动机材料,现在常压下向G中添加氧化铝,高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-xAlxOxY8-x.在接近于1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性.试问:“赛伦”中各元素的化合价为Si________,Al________,O________,Y________.
解析:(1)由G的相对分子质量及Si、N的质量分数,可以求出G的化学式为Si3N4.由E与NH3的复分解反应,可知E中含有Si和Cl两种元素,再据NH3与E的反应及二者的物质的量的关系,可求出E的化学式为SiCl4.
(2)由题意可知G与氧气和水反应生成的酸性氧化物为SiO2.因为G与氧气反应的产物还有一种单质,根据元素守恒,可判断该单质为N2,所以可以判断G与水反应生成的另一种产物为NH3,则G与水反应的化学方程式为Si3N4+6H2O===3SiO2+4NH3↑.
(3)不管是用x=4.0计算,还是用x=2.0计算,Y的化合价都为-3价.
答案:(1)①Si3N4 ②SiCl4
(2)Si3N4+6H2O===3SiO2+4NH3↑
(3)+4 +3 -2 -3

1.(2010·四川高考)节能减排对发展经济、保护环境有重要意义.下列措施不能减少二氧化碳排放的是( )
A.利用太阳能制氢
B.关停小火电企业
C.举行“地球一小时”熄灯活动
D.推广使用煤液化技术
解析:本题考查的知识点是化学与生产、二氧化碳与环境,意在考查考生对社会、环境的关注程度.煤液化后燃烧仍然会产生二氧化碳,所以选D.
答案:D
2.下列物质中不能通过置换反应生成的是( )
A.S B.CO
C.Fe3O4 D.F2
解析:F2的氧化性很强,不能通过F-发生置换反应生成.
答案:D
3.(2010·邯郸模拟)消毒剂在日常生活、医疗、卫生、防疫中都有重要的作用,下列消毒剂的使用不正确的是( )
A.过氧乙酸、漂白精是常用的消毒剂
B.食品加工、消毒防腐常使用福尔马林
C.因患禽流感而被隔离的地区,常用生石灰处理
D.医疗上常用75%的酒精进行消毒
解析:选项A,过氧乙酸、漂白精都具有强氧化性且使用安全、方便、消毒效果好,是常用的消毒剂.选项B,福尔马林有毒,不能用于食品工业.选项C,禽流感病毒是一种蛋白质,CaO遇水生成的Ca(OH)2能使蛋白质变性而杀死禽流感病毒.选项D,正确.
答案:B
4.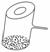 实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点.用此仪器不能反复进行的实验是( )
实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点.用此仪器不能反复进行的实验是( )
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
解析:KMnO4加热分解后的产物冷却后不能重新化合为KMnO4.
答案:B
5.某校化学兴趣小组的同学在实验中发现工业硝酸呈黄色,他们查阅资料后找到这样解释:工业硝酸呈黄色是由于NO2溶于浓硝酸引起的.“这个解释对吗?”,他们决定进行探究,请填写空白.
10.(2010·武汉模拟)将一定质量的铜粉加入到100 mL某浓度的稀硝酸中,充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体448 mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2 g,则(m1-m2)为( )
A.5.76 B.2.88
C.1.92 D.0
解析:根据3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,充分反应后溶液中n(NO)=3n(NO)=×3=0.06 mol.再加入足量稀硫酸,根据3Cu+8H++2NO===3Cu2++2NO↑+4H2O,溶解的n(Cu)=n(NO)=×0.06 mol=0.09 mol,故m1-m2=64×0.09=5.76.
答案:A
9.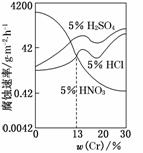 (2010·安徽高考)如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )
(2010·安徽高考)如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )
A.稀硝酸对FeCr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)===Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对FeCr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对FeCr合金的腐蚀性减弱
解析:由题知,稀硝酸在铬的含量大于13%时,对Fe?Cr合金的腐蚀性较弱,A不正确; 稀硝酸与铁反应产生的是NO,不是NO2,B不正确;从图中曲线的走势来看,腐蚀速率与溶液中H+的浓度关系并不大(因为各种情况下H+的浓度是一定的),主要还是取决于Cr的含量.
稀硝酸与铁反应产生的是NO,不是NO2,B不正确;从图中曲线的走势来看,腐蚀速率与溶液中H+的浓度关系并不大(因为各种情况下H+的浓度是一定的),主要还是取决于Cr的含量.
答案:D
8.已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下列描述正确的是( )
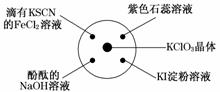
A.滴有KSCN的FeCl2溶液变红,说明Cl2具有还原性
B.滴有酚酞的NaOH溶液褪色,说明Cl2具有酸性
C.石蕊溶液先变红后褪色,说明Cl2具有漂白性
D.淀粉KI溶液中变蓝,说明Cl2具有氧化性
解析:A项说明Cl2具有氧化性.B项是Cl2先与H2O反应生成了酸.C项是Cl2与H2O反应生成的HClO具有漂白性.D项的反应为Cl2+2KI===2KCl+I2,说明Cl2具有氧化性.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com