
题目列表(包括答案和解析)
11.由化学能转变的热能或电能仍然是人类使用的主要能源.根据下图所示的装置,判断下列说法不正确的是
( )
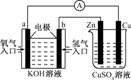
A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e-===2H2O
D.该装置中a极为正极,发生氧化反应
解析:该装置的左边是燃料电池,右边是电解池.a极为正极,发生还原反应;Cu极与电源正极连接,故为阳极;当铜片溶解了12.8 g时,失去电子12.8 g÷64 g/mol×2=0.4 mol,于是a极上O2得到电子也是0.4 mol,则消耗O2的物质的量是0.1 mol,在标准状况下的体积为2.24 L.
答案:D
10.金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是
( )
(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
解析:阳极发生氧化反应,A错误;电解过程中,阳极Zn、Fe、Ni溶解,阴极只有Ni析出,两电极质量的改变不等,B错误;电解液中除Zn2+、Fe2+外,还有Ni2+,C错误;阳极Ni、Zn、Fe溶解后,Cu、Pt沉积下来成为阳极泥,D正确.
答案:D
9.如下图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为
( )
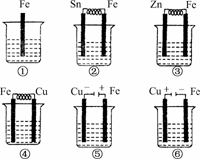
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
解析:②③④形成原电池,⑤⑥是电解池反应,金属被腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池的正极>电解池的阴极.
答案:C
8.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-12H2O
负极反应:C6H12O6+6H2O-24e-6CO2↑+24H+
则有关该电池的下列说法正确的是
( )
A.该电池的工作环境是高温条件
B.作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原
C.该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等
D.该电池的总反应为C6H12O6+6O26CO2+6H2O
解析:题目中指出“条件温和”,所以选项A是错误的;选项B中作为正极的葡萄糖(C6H12O6)在变化中失去电子,被氧化,所以错误;选项C中硝酸不可以作电解质溶液,浓硫酸与有机物会发生脱水等.把正极和负极的反应相加可以得出该电池的总反应为C6H12O6+6O26CO2+6H2O.
答案:D
7.为使反应:Cu+2H2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池
B.用铜片作电极,外接直流电源电解硫酸铜溶液
C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解稀硫酸
解析:选项A不能构成原电池,不发生反应,A错;B选项相当于精炼铜,B错;D项发生反应是Cu+2H+===Cu2++H2↑,故D错;C选项电解时,阳极Cu发生氧化反应,阴极上水电离出的H+发生还原反应,故反应为Cu+2H2O===Cu(OH)2+H2↑,所以正确答案C.
答案:C
6.用石墨做电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况
( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
解析:电解CuSO4的总反应方程式为 2CuSO4+2H2O2Cu+O2↑+2H2SO4,故从溶液中析出的物质是Cu和O2,每放出1 mol O2即析出2 mol Cu,Cu与O的物质的量之比为1∶1,所以,加入CuO可使溶液恢复原状.
答案:B
5.下列有关原电池和电解池的叙述正确的是
( )
A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH-+6e-===CO2+5H2O
C.在铁上镀铜时,金属铜作阴极
D.电解精炼铜时,电解质溶液中铜离子浓度基本不变
解析:纯锌与稀硫酸反应时,加入少量CuSO4溶液,可形成原电池,使反应速率加快,所以A正确;B中负极应失电子;C中金属铜应作阳极;D中电解精炼铜时,电解质溶液中铜离子浓度要发生变化.
答案:A
4.铅蓄电池放电时发生下列变化:
负极:Pb+SO-2e-===PbSO4 正极:PbO2+4H++SO+2e-===PbSO4+2H2O
使用该电池电解CuSO4溶液,要得到纯铜1.6 g,这时铅蓄电池消耗的H2SO4的物质的量为
( )
A.0.025 mol B.0.05 mol
C.0.1 mol D.0.2 mol
解析:蓄电池反应→电解CuSO4,电子转移相等.
2H2SO4-2e--Cu
2 mol 64 g
x 1.6 g
x==0.05 mol.
答案:B
3.下列有关电化学的图示,完全正确的是
( )
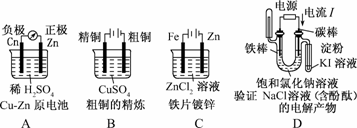
解析:A项中,Zn比Cu活泼,负极应为Zn,正极应为Cu;B项中,粗铜精炼时,应让粗铜作阳极与电源正极相连;C为电镀池,电镀时铁片即镀件应作阴极,锌片即镀层金属应作阳极;D项中,应首先根据电流方向判断出右端为阳极,左端为阴极,实质为用惰性电极电解饱和食盐水,阴极放出H2,用向下排气法收集,阳极为Cl-放电生成Cl2,用淀粉KI溶液检验.
答案:D
2.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(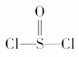 )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是
( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
解析:由电池总反应式可知,Li失电子,作电池的负极,石墨作电池的正极,故B选项不正确;Li为碱金属,易与水发生反应:2Li+2H2O===2LiOH+H2↑,故A选项不正确;电池工作过程中,SOCl2被还原为S,故C选项不正确;由电池总反应式知,8 mol Li参与反应,可提供8 mol e-,同时在正极析出2 mol S,故本题正确选项为D.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com