
题目列表(包括答案和解析)
20.(7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
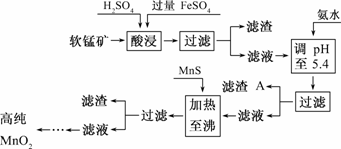
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%) 等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
pH |
|
Al(OH)3 |
5.2 |
|
Fe(OH)3 |
3.2 |
|
Fe(OH)2 |
9.7 |
|
Mn(OH)2 |
10.4 |
|
Cu(OH)2 |
6.7 |
|
Zn(OH)2 |
8.0 |
|
CuS |
≥-0.42 |
|
ZnS |
≥2.5 |
|
MnS |
≥7 |
|
FeS |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________________.
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种).
解析:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,可以写其反应方程式2FeSO4+MnO2+2H2SO4===MnSO4+Fe2(SO4)3+2H2O.
(2)根据反应后滤液(Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+)加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH)3和Al(OH)3.
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+.
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子.其电极反应式应为 MnO2+H2O+e-===MnOOH+OH-.
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2.
答案:(1)MnO2+2FeSO4+2H2SO4===MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3
(3)Cu2+、Zn2+
(4)MnO2+H2O+e-===MnOOH+OH-
(5)Zn、MnO2
19.(10分)在玻璃圆筒中盛有两种无色的互不相溶的中性液体,上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.根据上述实验回答:
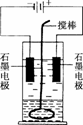
(1)阳极上的电极反应式为________.
(2)阴极上的电极反应式为________.
(3)原上层液体是________.
(4)原下层液体是________.
(5)搅拌后两层液体颜色发生变化的原因是__________________________________.
(6)要检验上层液体中含有的金属离子,其方法是______________________________,现象是__________________________________.
解析:(1)据题目现象可判断出阳极产物为I2,故电极反应为2I--2e-===I2;
(2)阴极产生无色气泡,说明H+放电,反应为2H++2e-===H2↑;
(3)结合(1)(2)分析可知上层液体为活泼金属碘化物,可为KI或NaI;
(4)下层液体难溶于水且比水的密度大的有机溶剂通常为CCl4;
(5)因I2易溶于有机溶剂,故搅拌后I2溶于CCl4中,所以下层液体呈紫红色;
(6)检验K+(或Na+),可通过焰色反应来证明.
答案:(1)2I--2e-===I2
(2)2H++2e-===H2↑
(3)KI(或NaI等)水溶液
(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色(其他合理答案同样给分.例如,若③中答NaI水溶液,这里答火焰呈黄色)
18.(7分)甲、乙两池的电极材料都是铁棒与碳棒(如下图).请回答下列问题:
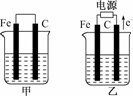
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒.
②在乙池中阴极的电极反应式是________________.
(2)若两池中均盛放饱和NaCl溶液,反应一段时间后:
①写出乙池中发生的总反应的离子方程式____________________.
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化.若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为____________________.
③若乙池转移0.02 mol电子后停止实验,池中溶液的体积是200 mL,则溶液混匀后的pH=________.
解析:甲池为原电池,乙池为电解池,且甲池中Fe为负极,乙中Fe为阴极,C为阳极.
(1)均盛放CuSO4溶液时,甲池中发生的反应为Fe+Cu2+===Fe2++Cu,乙池中发生的反应为2Cu2++2H2O2Cu+4H++O2↑.
(2) ①均盛放NaCl溶液时,甲池中发生吸氧腐蚀,乙池中发生的反应为2Cl-+2H2OCl2↑+H2↑+2OH-,②Cl2再氧化I2,结合物质的量之比为5∶1,利用电子守恒即得出方程式为5Cl2+I2+6H2O===10HCl+2HIO3.③2Cl-+2H2OCl2↑+H2↑+2OH-,因此每生成2 mol OH-,即转移2 mol e-,所以n(OH-)=n(e-)=0.02 mol, c(OH-)==0.1 mol/L,
所以pH=13.
答案:(1)①碳(C) 铁(Fe)
②Cu2++2e-===Cu
(2)①2Cl-+2H2O2OH-+H2↑+Cl2↑
②5Cl2+I2+6H2O===10HCl+2HIO3
③13
17.(10分)工业上处理含Cr2O的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.试回答:
(1)电解时的电极反应:阳极________________,阴极__________________________.
(2)Cr2O转变成Cr3+的离子反应方程式:_____________________.
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?
______________________________________.
(4)能否用Cu电极来代替Fe电极?________(填“能”或“不能”),简述理由______________________.
解析:(1)阳极Fe为活性电极,反应为Fe-2e-===Fe2+,在阴极是H+放电生成H2,反应为2H++2e-===H2↑.
(2)阳极生成的Fe2+具有较强的还原性,易被酸性条件下的Cr2O氧化,反应为6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O.
(3)因在阴极H+放电,同时Cr2O氧化Fe2+时都要消耗H+ ,使溶液的pH上升,促使Fe3+、Cr3+水解并最终完全转化为Cr(OH)3、Fe(OH)3沉淀.
(4)若用Cu代替Fe电极,则Cu-2e-===Cu2+,但Cu2+无还原性,不能将Cr2O还原.
答案:(1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O
(3)在阴极反应及Cr2O与Fe2+反应的过程中,将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀
(4)不能 因为阳极产生的Cu2+不能使Cr2O还原到低价
16.下列关于实验现象的描述不正确的是
( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作阳极,铁片作阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
解析:铜、铁是两种活泼性不同的金属,稀硫酸是电解质溶液,三者共同形成原电池,铁片上发生氧化反应:Fe-2e-===Fe2+,铜片上发生还原反应:2H++2e-===H2↑,故A选项正确.
B选项中的条件相当于在铁片上镀锌即电镀池,锌片上发生的反应为:Zn-2e-===Zn2+,铁片上发生的反应为:Zn2++2e-===Zn,理论上ZnCl2溶液的浓度不变,故B选项也正确.
Cu+2FeCl3===2FeCl2+CuCl2,故C选项错误.
Zn+2HCl===ZnCl2+H2↑,向其中加入几滴氯化铜溶液后,发生反应Zn+Cu2+===Zn2++Cu,则铜和锌及电解质溶液形成了原电池,发生原电池反应,加快了氢气的放出速率,故D选项也正确.
答案:C
第Ⅱ卷 (非选择题,共52分)
15.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O  Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是
( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
解析:充电时为电解池,阳极Ni(OH)2发生氧化反应,A正确;充电时,电能转化为化学能,B错误;放电时负极为Cd,反应为Cd-2e-+2OH-===Cd(OH)2,故c(OH-)减小,pH减小,C错误;放电时,阴离子向负极移动,D错误.
答案:A
14.(2009·安徽蚌埠质检)下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
( )
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是正极
解析:A项中失电子多少不能说明失电子难易,例如Al与Na;B项中甲的阳离子氧化性强,则甲的还原性弱;C项正确;D项中甲作正极,则甲不如乙活泼.
答案:C
13.如图所示,下列叙述正确的是
( )
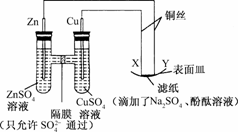
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
解析:图中左边装置是以Zn、Cu为电极的原电池装置,该电池中,Zn极为负极,Cu极为正极,而右边为电解池,根据连接情况可以推知,X为阳极,发生氧化反应,Y为阴极,发生还原反应,两极的电极反应式分别为X:4OH--4e-===2H2O+O2↑,Y:2H++2e-===H2↑,从而可得出答案应为A.
答案:A
12.铁锈的成分中含有铁的氧化物、铁的氢氧化物.研究证明,铁器的生锈与大气中的氧气、水蒸气有关.下列做法中最有利于减缓铁器生锈的是
( )
A.铁锅用完后用水刷洗干净其表面的油污
B.久置不用的铁刀涂抹凡士林在空气中保存
C.将铁壶盛水后保存
D.铁勺、铁铲放在阴湿处保存
解析:铁锅表面的油污用水刷洗掉后,铁直接与空气接触,而且铁锅刷洗后,表面有水,极易生锈;铁刀用凡士林涂抹后,使Fe与空气隔绝,可以减缓其生锈;铁器接触水,或在潮湿的空气中容易发生电化学腐蚀而生锈.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com