
题目列表(包括答案和解析)
9.某同学按下图所示的装置进行电解实验.下列说法正确的是
( )
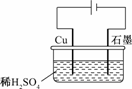
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
解析:活泼金属铜作阳极,阳极发生反应:Cu-2e-===Cu2+,初期阴极溶液中H+放电:2H++2e-===H2↑,溶液中的pH不断增大,总方程式为Cu+H2SO4CuSO4+H2↑.随着反应进行,溶液中Cu2+数目增多,此时阴极上溶液中Cu2+得电子:Cu2++2e-===Cu,此时,该装置为电镀铜,溶液中的pH保持不变.
答案:BC
8.关于铅蓄电池的说法正确的是
( )
A.在放电时,正极发生的反应是Pb(s)+SO(aq)-2e-===PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-===Pb(s)+SO(aq)
解析:A项中电池放电时正极应发生还原反应,电极反应为:PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l);C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阴极应发生还原反应.
答案:B
7.近年来,加“碘”食盐较多使用了碘酸钾(KIO3),KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应方程式为KI+H2O―→KIO3+H2↑.下列有关说法中正确的是
( )
A.电解时,石墨作阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤―→浓缩―→结晶―→灼烧
D.电解中,每转移0.6 mol电子,理论上可得到0.1 mol无水KIO3晶体
解析:本题利用电解原理制取碘盐中的碘酸钾,由方程式可知,发生氧化反应的物质是I-,故应用惰性材料作阳极,A项正确;电解池工作时,阳极I-失电子生成IO,而不是生成H2,H2应在阴极上生成,B项错误;电解后所得溶液为KIO3、KI的混合液,应采用浓缩―→结晶―→过滤的方法,因为KIO3不太稳定,所以不能用灼烧的方法得到,C项错误; ―→O转移6 mol e-,生成1 mol KIO3,故每转移0.6 mol e-理论上可得到0.1 mol无水KIO3晶体,D项正确.
答案:AD
6.(2009·山东潍坊质检)一些科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了氨的电化学合成.该过程N2和H2的转化率远高于现在工业上使用的氨合成法.对于电化学合成氨的有关叙述正确的是
( )
A.N2在阴极上被氧化
B.可选用铁作为阳极材料
C.阳极的电极反应式是N2+6e-+6H+===2NH3
D.该过程的总反应式是N2+3H2通电(一定条件2NH3
解析:据题意知总反应式为N2+3H22NH3,故N2应在阴极发生还原反应,故A、C错误;H2在阳极上失电子,故阳极应为惰性电极,B错误.
答案:D
5.用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳板上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
( )
A. B.
C. D.
解析:用惰性电极电解硝酸盐溶液时,两极发生的反应分别是:阳极4OH--4e-===2H2O+O2↑,阴极Mx++xe-===M;设m为M的相对原子质量,根据电子守恒原理得:x=,所以m=.
答案:C
4.(2009·广州调研)为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是
( )
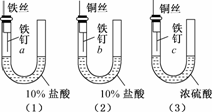
A.实验结束时,装置(1)左侧的液面一定会下降
B.实验结束时,装置(1)左侧的液面一定比装置(2)的低
C.实验结束时,铁钉b腐蚀最严重
D.实验结束时,铁钉c几乎没有被腐蚀
解析:(1)中发生化学腐蚀:Fe+2HCl===FeCl2+H2↑
(2)中发生析氢腐蚀,Cu为正极,铁钉为负极.
(3)中不被腐蚀,因为浓H2SO4有吸水性,铁钉不能发生电化学腐蚀,故选B.
答案:B
3.按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
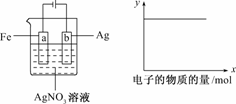
①c(Ag+) ②c(NO) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④
C.①②④ D.①②⑤
解析:由图象知:装置是电镀池,所以AgNO3溶液浓度不变.
答案:D
2.下列关于铜电极的叙述正确的是
( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
解析:A项,锌比铜活泼,故铜作正极,正确;B项,电解冶炼铜时,粗铜作阳极,错误;电镀时,待镀金属作阴极,C正确;电解H2SO4制H2、O2时,阳极必为惰性电极,D错误.
答案:AC
1.(2009·镇江六校联考)用惰性电极和串联电路电解下列物质的水溶液:①NaCl, ②NaNO3, ③CuCl2, ④AgNO3,在相同时间内生成气体的总体积(同温同压下测定),理论上由多到少的顺序是
( )
A.①②③④ B.④①②③
C.②①③④ D.①②④③
解析:依题意,各个电解质溶液中发生的电极反应为:
①2Cl--2e-===Cl2↑,2H++2e-===H2↑;
②4OH--4e-===2H2O+O2↑,4H++4e-===2H2↑;
③2Cl--2e-===Cl2↑,Cu2++2e-===Cu;
④4OH--4e-===2H2O+O2↑,4Ag++4e-===4Ag.
因为是串联,所以转移电子数目相同,设转移电子2 mol,则①共生成 2 mol气体,②生成1. 5 mol气体,③生成1 mol气体,④生成0.5 mol气体,A选项正确.
答案:A
22.(10分)某学生试图用电解法根据电极上析出物质的质量来验证阿伏伽德罗常数的值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图:
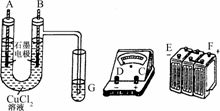
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g.
试回答:
(1)连接这些仪器的正确顺序为:(用图中标注仪器接线柱的英文字母表示,下同)E接________,C接________,________接F.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为__________________,相应的离子方程式是__________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电荷量为1.6×10-19 C.试列出阿伏伽德罗常数的计算表达式:NA=________.
解析:(1)B电极上应产生Cl2:2Cl--2e-===Cl2↑,B极上流出电子,电子进入直流电源的正极,即F极,由此可得仪器连接顺序及电流方向.
(2)B中产生Cl2,Cl2进入G中与KI反应,有I2生成,I2使淀粉变蓝色.
(3)镀在A电极上的Cu是没必要刮下的,也无法刮干净,故②⑤两步须排除在外.
(4)因为析出Cu的物质的量= mol,电子转移物质的量为×2 mol,即×2×NA个电子,由于电子的电荷量为1.6×10-19C,所以×2×NA×1.6×10-19=It,
则 NA=×mol-1
答案:(1)D A B
(2)2Cl--2e-===Cl2↑ 溶液变蓝
Cl2+2I-===2Cl-+I2
(3)①③④⑥
(4)×mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com