
题目列表(包括答案和解析)
5.人们利用原电池原理,制作了多种电池,如电子计算机所用钮扣电池就是其中一种.它的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-===ZnO+H2O;Ag2O+H2O+2e-===2Ag+2OH-.下列判断正确的是
( )
A.锌为正极,Ag2O为负极
B.锌为负极,Ag2O为正极
C.原电池工作时,负极区溶液pH减小
D.原电池工作时,负极区溶液pH增大
解析:原电池中失去电子的电极为负极,所以锌为负极,Ag2O为正极,B是正确答案.因为Zn+2OH--2e-===ZnO+H2O,负极区域溶液c(OH-)不断减少,故pH减小,所以C也正确.
答案:BC
32.5 g 1 mol 1 mol 0.5 mol
故A正确.
答案:A
4.在铜-锌-稀硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上的两极变化是
( )
①锌片溶解了32.5 g ②锌片增重了32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
A.①③ B.①④
C.②③ D.②④
解析:铜-锌-稀硫酸构成的原电池反应为:
负极Zn- 2e-===Zn2+ 正极2H++2e-=== H2↑
65 g 2 mol 2 mol 1 mol
3.(2009·山东济宁模拟)一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2.则下列说法中正确的是
( )
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-===2CO
C.负极发生的电极反应是:CO+CO-2e-===2CO2
D.正极发生氧化反应
解析:据题意知通入CO的一极为电源的负极,CO失去电子转变为CO2,负极发生氧化反应,故A、B、D错误,C正确.
答案:C
2.在用Zn片、Cu片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法正确的是
( )
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片
C.溶液中硫酸的物质的量浓度减小
D.电解质溶液的pH保持不变
解析:活泼金属锌为负极,电流方向由正极到负极,与电子流动方向相反.随着H+消耗,溶液的pH逐渐增大.
答案:C
1.“嫦娥”一号(如右图)的供配电由同位素电池(利用放射性同位素在衰变时释放巨大能量的原理制作)、太阳能电池、镍氢蓄电池组提供.当月球探测器穿过月食有效阴影区时,由于在月食阴影区没有太阳照射,会引起太阳能电池无法工作,动力由携带的蓄电池提供.下列说法不正确的是
( )

A.太阳能电池可以充当镍氢蓄电池的电源
B.蓄电池放电的电子流向为正极→负极
C.若仅从保护环境的角度考虑,要尽量使用太阳能电池和镍氢蓄电池
D.镍氢蓄电池放电时的正极要与外加电源的正极相连
解析:镍氢蓄电池为可充电电池,充电时可用太阳能电池作电源,A正确;其放电时为原电池装置,电子应从负极流出流向正极,B错误;太阳能电池无污染,而镍氢电池为可充电电池,降低了污染,C正确;镍氢电池放电时的正极要与外加电源的正极相连,D正确.
答案:B
13.(2009·全国Ⅰ理综高考)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极.
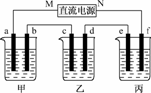
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为____________________极;
②电极b上发生的电极反应为____________________;
③列式计算电极b上生成的气体在标准状况下的体积:
______________________________;
④电极c的质量变化是__________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________;
乙溶液______________________________;
丙溶液______________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
________________________________________.
解析:(1)①乙中c电极质量增加,说明c处发生的反应为:Cu2++2e-===Cu,c电极应为阴极,则M为负极,N为正极.
②甲中放的是NaOH溶液,电解时实质上是电解水,b电极上发生的电极反应为:4OH--4e-===2H2O+O2↑.而要求算出b电极上产生的气体体积,就必须先根据丙中K2SO4浓度的变化计算出转移电子的数目.
设丙中电解水的质量为x g,
由电解前后溶质质量相等可得:100×10%=(100-x )×10.47%,x =4.5g,所以整个反应转移了0.5 mol电子,根据电极方程式可计算出b电极放出的O2为0.125 mol,其体积为2.8 L,c电极上析出的铜为0.25 mol,其质量为16g.
⑤甲中电解的是水,NaOH浓度增大;乙中水电离出来的OH-放电,H+浓度增大;丙中电解的也是水,虽然K2SO4浓度变大,但pH不变.
(2)铜全部析出时溶液变为H2SO4溶液,电解仍可以进行.
答案:(1)①正
②4OH--4e-===2H2O+O2↑
③水减少的质量:100g×(1-)=4.5g
生成O2体积:××22.4L·mol-1=2.8L
④16
⑤碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大 酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加 酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
12.(2009·宁夏模拟)已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解.某研究性学习小组的学生在一次活动中,设计出如下方案来测定铜的相对原子质量:
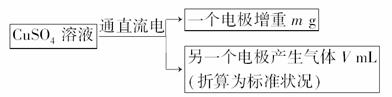
指导老师认为此方案可行,提供了一瓶含有一定量H2SO4、Fe2(SO4)3杂质的CuSO4溶液及其他相关药品、器材.
(1)需要先提纯,加入________(填写试剂化学式),反应后经过滤即可提纯CuSO4溶液.有关离子方程式:________________.
(2)用铜和石墨两个电极电解CuSO4溶液,铜电极应接电源的________极,石墨电极上的电极反应式:________.
(3)写出Cu的相对原子质量的表达式:________.
解析:(1)可向混合液中加入CuO,消耗H+,调节溶液的pH至4-5,使Fe(OH)3沉淀完全.
(2)电解CuSO4溶液,若铜作阳极,则阳极发生氧化反应:Cu-2e-===Cu2+,阴极则发生还原反应 :Cu2++2e-===Cu,因要求一个电极增重,另一个电极产生气体,则必须选用石墨作阳极,铜作阴极,阳极上OH-放电:4OH--4e-===2H2O+O2↑.
(3)由阴阳两极得失电子数相等可得×2=×4,解得M=.
答案:(1)CuO Fe3++3H2O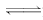
 Fe(OH)3+3H+
Fe(OH)3+3H+
CuO+2H+===Cu2++H2O
(2)负 4OH--4e-===2H2O+O2↑
(3)
11.某课外化学兴趣小组设计了如图所示装置(虚框内部分未画出),在装置内起初发生的反应为:
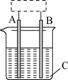
Cu+H2SO4===H2↑+CuSO4
(1)该装置的名称是________.
(2)A、B中至少有一种是金属________,接________.
(3)C溶液中含有________.
解析:由于铜的化学活泼性不如氢,所给化学反应不能自发进行,若要使铜能置换出硫酸中的氢元素,需要外加电源,该装置为电解池.在所给反应中铜被氧化,应与电源的正极相连接,故A、B中至少有一种为铜,C溶液应为稀硫酸.
答案:(1)电解池 (2)铜 电源的正极 (3)H2SO4
10.早在1807年化学家戴维用电解熔融氢氧化钠的方法制得钠:4NaOH(熔融)4Na+O2↑+2H2O;后来盖-吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH(熔融)Fe3O4+2H2↑+4Na↑.下列有关说法正确的是
( )
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-===H2↑+O2↑
B.盖-吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖-吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠,电解时可用石墨作阳极,铁作阴极
解析:电解熔融NaOH时,阳极OH-放电生成O2和H2O,A不正确.钠的还原性强于铁,B不正确.C项,假设分别制得4 mol钠,则转移电子数分别为4 mol、8 mol,C不正确.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com