
题目列表(包括答案和解析)
2.某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为了分别得到各含一种金属阳离子的沉淀,可采取:①通入H2S;②通入CO2,③加HCl溶液,④加NaOH溶液4个步骤,设试剂均过量,且每次都把所生成的沉淀过滤出来.其正确的操作顺序是
( )
A.③①④② B.①③④②
C.④②①③ D.④②③①
解析:四种粒子形成的沉淀分别为Fe(OH)2 、Al(OH)3、AgCl、CuS.
答案:A
1. 观察下图,若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是
( )
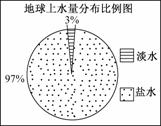
A.100 mL烧杯 B.50 mL烧杯
C.100 mL量筒 D.50 mL量筒
解析:此题以实验题面目出现,考查了烧杯和量筒两种常见仪器,对学生的能力要求不高,但有教育学生珍惜水资源的寓意.A和B两选项都是烧杯,它不能较精确地测量液体体积;要较精确地测量出1000×3%mL水的体积,应选50 mL量筒,即D.
答案:D
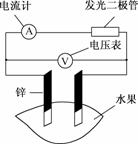
13.某同学用下图所示做水果电池的实验,测得数据如下表所示:
|
实验编号 |
电极材料 |
水果品种 |
电极间距/cm |
电压/mV |
|
|
1 |
锌 |
铜 |
菠萝 |
3 |
900 |
|
2 |
锌 |
铜 |
苹果 |
3 |
650 |
|
3 |
锌 |
铜 |
柑橘 |
3 |
850 |
|
4 |
锌 |
铜 |
西红柿 |
3 |
750 |
|
5 |
锌 |
铝 |
菠萝 |
3 |
650 |
|
6 |
锌 |
铝 |
苹果 |
3 |
450 |
请回答以下问题:
(1)实验6中负极的电极反应式为________.
(2)实验1、5中电流方向相反的原因是________.
(3)影响水果电池的电压的因素有________、________.
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再按发光二极管,这样做________.(填“合理”或“不合理”)
解析:(1)实验6中电极是Zn与Al,因Al更活泼,故负极反应为Al-3e-===Al3+.
(2)因实验1中锌比铜活泼,锌为负极;实验5中铝比锌活泼,锌为正极,故两实验中电流方向相反.
(3)由实验1和5可知,水果电池的电压与水果的品种及电极材料有关.
(4)这样做可使电压增大,合理.
答案:(1)Al-3e-===Al3+
(2)实验1中锌比铜活泼,锌为负极;实验5中锌比铝活泼性差,锌为正极,所以两实验中电流方向相反
(3)水果品种 电极材料 (4)合理
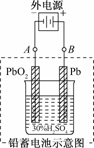
12.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
 Pb+PbO2+4H++2SO
Pb+PbO2+4H++2SO 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g.
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________.
解析:(1)根据装置和电池反应判断:负极是Pb,正极是PbO2,放电时的电极反应为:
负极:Pb-2e-+SO===PbSO4
正极:PbO2+2e-+4H++SO===PbSO4+2H2O
反应中H2SO4不断被消耗,故浓度变小,又根据电极反应判断两极均有PbSO4生成,每转移1 mol电子,两极均有0.5 mol PbSO4生成,对于负极将增加0.5 mol SO,质量为96 g/mol×0.5 mol=48 g.
(2)按题图连接后,变为电解池,A极上发生的反应为PbSO4+2e-===Pb+SO,而B极上发生的反应为PbSO4+2H2O-2e-===PbO2+4H++SO,故A、B两极上将分别生成Pb和PbO2,且工作时蓄电池正负极的极性已对换.
答案:(1)PbO2+2e-+4H++SO===PbSO4+2H2O 小 48
(2)Pb PbO2 对换
11.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2===2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为________________,
②正极反应式为________________,
③工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(2)如把KOH改为稀H2SO4作电解质,则:
①负极反应式为________________,
②正极反应式为________________,
③工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为____________________.
解析:(1)电解质为KOH溶液时,溶液呈碱性,负极反应中H2生成H+,而H+不能与OH-共存;另外正极反应中O2在碱性溶液中只能生成OH-.
负极反应:2H2+4OH--4e-===4H2O
正极反应:O2+2H2O+4e-===4OH-,方程式为:2H2+O2===2H2O,所以工作一段时间后,溶液的pH减小.
(2)电解质为H2SO4时,溶液呈酸性,负极反应中H2生成H+,H+能与硫酸根离子共存;另外正极反应中O2在酸性溶液里只能生成水.
负极反应:2H2-4e-===4H+
正极反应:O2+4H++4e-===2H2O,同样总反应为2H2+O2===2H2O,工作一段时间后,溶液pH增大.
(3)电解质为KOH溶液,正极上反应的物质是O2,所以H2O必须写入反应式中,O2生成OH-.
正极反应:O2+2H2O+4e-===4OH-
答案: (1)①2H2+4OH--4e-===4H2O ②O2+2H2O+4e-===4OH- ③减小
(2)①2H2-4e-===4H+ ②O2+4H++4e-===2H2O ③增大
(3)O2+2H2O+4e-===4OH-
10.将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量CuSO4溶液.下图表示产生氢气的体积V与时间t的关系,其中正确的是
( )
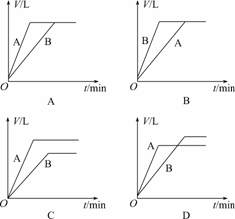
解析:在A中加入少量CuSO4,则有少量Zn置换铜,从而构成锌铜原电池,使反应速率增大,这样与H2SO4反应产生H2的Zn的量减小,所以产生H2的体积减小,故D符合.
答案:D
9.(2009·茂名高考模拟)可以将反应Zn+Br2===ZnBr2设计成可充电电池,下列4个电极反应:
①Br2+2e-===2Br- ②2Br--2e-===Br2
③Zn-2e-===Zn2+ ④Zn2++2e-===Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
( )
A.②和③ B.②和①
C.③和① D.④和①
解析:放电原理是原电池原理,较活泼的金属作为原电池的负极,故放电时负极反应为③.充电原理是电解原理,在可充电电池中,阳极所发生的反应为补充原来正极的反应,即用来补充消耗掉的Br2,故反应为②,即选项A正确.
答案:A
8.下列说法正确的是
( )
A.碱性锌锰电池是二次电池
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质没有储存在电池内部
解析:碱性锌锰电池属于干电池类,故应为一次电池.铅蓄电池是可充电电池,即它放电后可以再充电使电池内部的活性物质获得再生,又叫二次电池.燃料电池与普通电池的区别就在于燃料电池的活性物质没有储存在电池内部,而是由外部进行不断的供应.所以本题正确的选项是C、D两项.
答案:CD
7.镍镉(Ni-Cd)可充电电池在现代生活中被广泛应用,它充电、放电时按下式进行:Cd(OH)2+2Ni(OH)2充电放电Cd+2NiOOH+2H2O,由此可知,该电池放电时的负极材料是
( )
A.Cd(OH)2 B.Ni(OH)2
C.Cd D.NiOOH
解析:放电时为原电池,要注意上式向左进行为放电.负极发生氧化反应,失电子,化合价升高,故负极材料为Cd,C项正确.
答案:C
6.(2009·福建理综高考)控制适合的条件,将反应2Fe3++2I-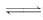
 2Fe2++I2设计成如下所示的原电池.下列判断不正确的是
2Fe2++I2设计成如下所示的原电池.下列判断不正确的是
( )
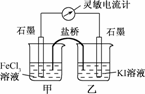
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
解析:由反应2Fe3++2I-
 2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,乙中I-发生氧化反应;电流计读数为零,说明单位时间内由甲流向乙的电子数与由乙流向甲的电子数相等,生成Fe3+的物质的量与消耗的Fe3+相等,则反应达到了平衡状态,此时在甲中溶入FeCl2固体,则平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极;故选D.
2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,乙中I-发生氧化反应;电流计读数为零,说明单位时间内由甲流向乙的电子数与由乙流向甲的电子数相等,生成Fe3+的物质的量与消耗的Fe3+相等,则反应达到了平衡状态,此时在甲中溶入FeCl2固体,则平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极;故选D.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com