
题目列表(包括答案和解析)
13.(2009·苏州模拟)实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
( )
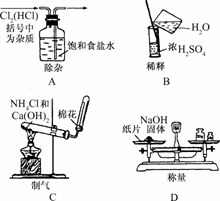
解析:A中气体应长进短出;B中有两处错误,一是不能在量筒中稀释浓硫酸,二是不能将水倒入浓H2SO4中;D中称量NaOH固体不能放在纸片上,应放在烧杯中称量;C中所用原料、方法、装置均正确.
答案:C
12.(2009·石家庄质检)工业上以CaO和HNO3 为原料制备Ca(NO3)2·4H2O晶体.为了确保制备过程中既不补充水,也无多余水分,所用硝酸溶液溶质的质量分数应为
( )
A.30% B.63%
C.70% D.无法确定
解析:反应方程式为:
CaO+2HNO3+3H2O===Ca(NO3)2·4H2O,
硝酸质量分数为×100%=70%.
答案:C
11.在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2、Al2(SO4)3和Fe2(SO4)3溶液,这种试剂是
( )
A.NaOH B.NH3·H2O
C.AgNO3 D.BaCl2
解析:加入NaOH溶液,有刺激性气味产生的是(NH4)2SO4,无明显现象的是KCl,产生白色沉淀的是MgCl2,先生成白色沉淀后来沉淀又溶解消失的是Al2(SO4)3,产生红褐色沉淀的是Fe2(SO4)3;加入NH3·H2O、(NH4)2SO4和KCl无法鉴别开,MgCl2与Al2(SO4)3均会产生白色沉淀,也鉴别不开;五种盐溶液中,有2种氯化物,3种硫酸盐,因此利用Ag+、Ba2+无法鉴别,故只有A正确.
答案:A
10.如下图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
( )
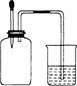
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④ C.③④ D.②③
解析:在光照条件下,CH4与Cl2发生化学反应,产物中有HCl生成,因HCl易溶于水,使集气瓶中压强减小,水会倒吸其中,②正确;当滴入水时,反应4NO2+O2+2H2O===4HNO3也会使集气瓶内压强减小,发生水倒吸入集气瓶中的现象,③正确;①中CO、O2均不溶于水,①错误;④中N2、H2也不溶于水,光照时也不发生反应,④错误,故D正确.
答案:D
9.(2010·广东、韶关模块考试)为了除去粗盐中的Ca2+、Mg2+、SO及泥沙,可将粗盐溶于水,然后进行下列五项操作.其中正确的操作顺序是
( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.④②⑤①③ D.⑤②④①③
解析:OH-与Mg2+反应产生难溶的Mg(OH)2沉淀,Ba2+与SO生成BaSO4沉淀,这两个过程互不影响,可以颠倒;加入CO可以除去Ca2+和过量的Ba2+;过滤,防止加酸使Mg(OH)2和CaCO3溶解;最后加酸中和过量的碱及除去CO,故只有D正确.
答案:D
8.下列叙述正确的是
( )
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g NH所含质子数相等
解析:1个N2分子含有2个氮原子,1个O3分子有3个氧原子,故相同条件下,等体积的N2和O3的混合气体与N2所含的原子数不相等,A错误;1个甲基含9个电子,1个羟基含9个电子,因此,等物质的量的甲基与羟基所含的电子数相等,B正确;常温常压下22.4 L O2不是1 mol,C错误;16 g CH4含质子数为×10×NA=10NA,18 g NH所含质子数为×11×NA=11NA,D错误.
答案:B
7.下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2 KSCN NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO3 Na2SiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2 (AgNO3溶液)
D.(NH4)3PO4 NaBr CuSO4 AlCl3 (KOH溶液)
解析:A项先用FeCl3溶液鉴别出Ba(OH)2、KSCN,再用Ba(OH)2溶液可鉴别NaCl、Mg(NO3)2; B项中现象依次是无现象、有无色无味气体产生,有无色刺激性气味的气体产生,产生白色沉淀,可直接鉴别;C项无法区别K2CO3和CaCl2(与AgNO3溶液反应均产生白色沉淀;D项将KOH溶液加入4种溶液中,现象依次是:产生刺激性气体、无现象、产生蓝色沉淀、产生白色沉淀然后逐渐溶解,可直接鉴别.
答案:C
6.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①、②、③、④是
( )
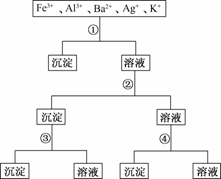
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
解析:Fe3+、Al3+都能与过量的NH3·H2O和NaOH溶液反应产生沉淀,Ba2+和Ag+均能与过量的H2SO4产生沉淀,因此要将5种离子彻底分离,应先加入NaCl,使Ag+沉淀,再加氨水,使Fe3+和Al3+沉淀,然后在沉淀中加NaOH溶液,使Al(OH)3溶解而与Fe(OH)3分离,在操作之后的溶液中加入H2SO4,使Ba2+产生BaSO4沉淀与K+分离,故答案为D.
答案:D
5.若NA表示阿伏加德罗常数的值,下列说法正确的是
( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
解析:Cl2作氧化剂时,还原产物为Cl-,所以1 mol Cl2得到2 mol电子,A错误;标准状况下,22.4 L H2是1 mol,氢原子为2NA个,B错误;14 g N2分子中含有的电子数为×14 NA=7NA,正确;NA个CO分子的质量为1 mol×28 g/mol=28 g,0.5 mol CH4的质量为0.5 mol×16 g/mol=8 g,所以二者的质量比为28 g∶8 g=7∶2,D错误.
答案:C
3.(2010·山东临沂月考)300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO的物质的量浓度为
( )
A.0.4 mol/L B.0.3 mol/L
C.0.2 mol/L D.0.1 mol/L
解析:n(Al3+)=1.62 g/27 g/mol=0.06 mol,n(SO)=0.09 mol.加入Ba(OH)2溶液中含Ba2+0.03 mol,剩余SO 0.06 mol,此时溶液的体积为600 mL,c(SO)=0.1 mol/L.
答案:D 4.下列装置或操作能达到实验目的的是
( )
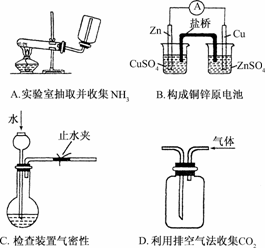
解析:A项中集气瓶口塞有塞子,会发生爆炸危险,A错误;B项不符合构成原电池的条件,错误;C项中关闭止水夹,利用注水法检查装置气密性,正确;D项中CO2比空气重,应长管进气,短管出气,D错误.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com