
题目列表(包括答案和解析)
1.下列实验操作不会引起安全事故的是
( )
A.用排水法收集气体后,先熄灭酒精灯,再取出导气管
B.用氢气还原氧化铜时,先加热再通入氢气
C.实验室制取氯气时,先加热二氧化锰,后滴入浓盐酸
D.混合浓硫酸和浓硝酸时,应将浓硫酸慢慢加入浓硝酸中并及时搅拌
解析:用排水法收集气体时,先熄灭酒精灯,再取出导气管,会造成倒吸,导致危险,故A错误;用氢气还原氧化铜时,先加热再通入氢气,可能会导致爆炸,因此这是一种错误的操作,所以B是错误的;C中要加热浓盐酸和二氧化锰的混合物,如加热干燥的二氧化锰,可能会造成烧瓶炸裂,因此C也不对;只有D选项正确.
答案:D
22.(8分)已知达喜是常用的中和胃酸的药物,其化学成分是铝和镁的碱式盐.
(1)取该碱式盐3.01 g,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比.
(2)在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74 g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式.
解析:(1)由题意可知:当加到HCl的物质的量为2.0 mol/L×42.5 mL×10-3L·mL-1=0.085 mol时开始产生CO2;而当加到2.0 mol/L×45.0 mL×10-3 L·mL-1=0.090 mol时正好反应完全.所以n(CO)=0.090 mol-0.085 mol=0.005 mol.又由于达喜为铝和镁的碱式盐,所以n(OH-)=0.085 mol-0.005 mol=0.08 mol.
所以==
(2)由已知得1.74 g沉淀为Mg(OH)2,得碱式盐中含n(Mg2+)==0.03 mol,利用Cl守恒得:
含n(Al3+)=
=0.01 mol,又由(1)得n(OH-)=0.08 mol、n(CO)=0.005 mol.因为0.03 mol×24 g/mol+0.01 mol×27 g/mol+0.08 mol×17 g/mol+0.005 mol×60 g/mol=2.65g<3.01 g.所以含有n(H2O)==0.02 mol.故n(Al3+)∶n(Mg2+)∶n(OH-)∶n(CO)∶n(H2O)=0.01 mol∶0.03 mol∶0.08 mol∶0.005mol∶0.02 mol=2∶6∶16∶1∶4.所以该碱式盐的化学式为Al2Mg6(OH)16CO3·4H2O.
答案:(1)16∶1 (2)Al2Mg6(OH)16CO3·4H2O
21.(2010·福建厦门质检)(9分)菠菜营养丰富,素有“蔬菜之王”之称,是一种高效的补铁剂,长期以来民间流传有“菠菜不能与豆腐同食”、“菠菜根比菠菜茎叶更有营养”等说法.某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁?
②菠菜是否含有草酸类物质?
③菠菜根中铁的含量是否比菠菜茎和叶的高?
该组同学通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水.
他们设计的实验步骤如下:
Ⅰ.
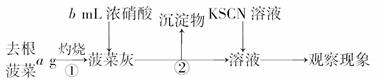
Ⅱ.取菠菜根a g使用相同仪器、试剂,重复Ⅰ中实验,观察实验现象.
Ⅲ.将菠菜在少量开水中煮沸2-3 min,冷却后滤去菠菜,得滤液.向滤液中加入足量Ca(OH)2溶液,然后再加入足量试剂X,观察现象.
请回答以下问题:
(1)操作①中使用的仪器除三脚架、酒精灯、玻璃棒外还需要________,操作②的名称是________.
(2)可以说明菠菜根中Fe元素含量要比菠菜茎叶中多的现象是_____________________.
(3)菠菜中的Fe是+2价还是+3价?________.
(4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质.由于滤液中含有CO,故需加入试剂X排除CO的干扰.则X是________(写化学式),加入试剂X后观察到的现象是__________.
解析:(1)加热固体物质时通常用坩埚,相应仪器还有坩埚钳、泥三角、三角架、酒精灯及玻璃棒,在除去难溶物时用过滤的方法.
(2)Fe3+与KSCN溶液作用会生成红色络合物,红色越深说明Fe3+的含量越高.
(3)据题目知菠菜中含有草酸类物质,而该物质有较强的还原性,故菠菜中的Fe不是+3价而是+2价.
(4)由题给信息可知酸性:草酸>乙酸>碳酸,所以可用乙酸来除去CO的干扰,加入CH3COOH后,CaCO3可以溶解,但草酸钙不与CH3COOH反应.
答案:(1)坩埚、坩埚钳、泥三角 过滤
(2)步骤Ⅱ中得到溶液的红色比步骤Ⅰ中得到溶液的红色深
(3)+2价 (4)CH3COOH 沉淀部分溶解
20.(10分)实验室需要480 mL 0.4 mol/L的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解.
②把①所得溶液小心转入一定容积的容量瓶中.
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm-2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切.
④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀.
⑤将容量瓶瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________.
(2)实验室有如下规格的容量瓶:①100 mL,②250 mL,③500 mL,④1000 mL,本实验选用________.
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有__________________.
(4)需要使用玻璃棒的操作有________(填序号),其作用为________________________.
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码)____________________.
②容量瓶用1 mol/L的NaCl溶液润洗________.
解析:(1)实验操作步骤为称量→溶解→转移→洗涤→定容→摇匀.
(2)容量瓶的规格相对固定,当所配溶液的体积与容量瓶规格不符时,应选择规格稍大的.
(3)选择仪器时特别注意不能遗漏特别小的仪器,如药匙、胶头滴管等.
(4)溶液配制过程中玻璃棒有两种用途:搅拌和引流.
(5)进行误差分析时,应结合公式c=分别分析错误操作对n和V的影响,进而确定对实验结果的影响.
答案:(1)①②④③⑤ (2)③
(3)天平、药匙、烧杯、胶头滴管、量筒
(4)①②③④ ①:搅拌,促进溶解;②③④:引流
(5)①偏低 ②偏高
19.(11分)水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等.请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2.(加热装置和导管等在图中略去)
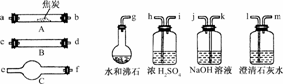
回答下列问题:
(1)盛浓H2SO4的装置用途是________,盛NaOH溶液的装置用途是________.
(2)仪器B中需加入试剂的名称(或化学式)是________,所发生反应的化学方程式是____________________.
(3)仪器C中需加入试剂的名称(或化学式)是________,其目的是__________________.
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:g-ab-___________________.
(5)能证明混合气体中含有CO的实验依据是__________________________________.
(6)能证明混合气体中含有H2的实验依据是____________________________.
解析:本题关键是应明确实验目的(证明混合气体中有CO和H2),要想达到目的,只能利用它们的还原性将之转化为CO2和H2O来检验,同时又要防止原混合气体中CO2和水蒸气的干扰,所以,用CO、H2还原CuO之前,必须首先除去CO2和水蒸气.本题应首先解决第(4)问.
答案:(1)除去水蒸气 除去CO2
(2)氧化铜(CuO)
CuO+H2Cu+H2O、CuO+COCu+CO2
(3)无水硫酸铜(CuSO4) 检验H2O
(4)(g-ab)-kj-hi-cd(或dc)-fe-lm
(5)原混合气体中的CO2已被除去,其中CO与CuO反应生成的CO2使澄清石灰水变浑浊
(6)原混合气体中的H2O已被除去,其中H2与CuO反应生成的H2O使无水硫酸铜由白色变为蓝色
18.(8分)某研究性学习小组成员在讨论鉴别食盐水和蒸馏水的方案时,设计如下方案:
|
|
实验方法 |
结论 |
|
甲 |
加AgNO3溶液 |
有白色沉淀产生者为食盐水 |
|
乙 |
利用焰色反应 |
焰色为黄色者为食盐水 |
|
丙 |
加入无水
CuSO4白色粉末 |
溶液变蓝者为蒸馏水 |
|
丁 |
加入稀硫酸和MnO2,加热 |
有黄绿色气体产生者为食盐水 |
(1)其中可行的方法是____________________.
(2)说明其中不可行的方法的原因____________________________.
(3)请给出另外一种鉴别方法(不可以用尝味道,闻气味方法).
|
实验方法 |
结论 |
|
|
|
解析:据NaCl溶液中阴离子为Cl-,可加入AgNO3溶液,会产生白色沉淀AgCl,根据阳离子为Na+,可用焰色反应来鉴别,故甲、乙均可行;把无水CuSO4白色粉末加入食盐水中,溶液也变成蓝色,丙方案不可行,而在食盐水中加入稀H2SO4和MnO2,加热不发生化学反应,丁方案不可行.鉴别食盐水和蒸馏水还可通过加热蒸发或测溶液的导电性.
答案:(1)甲、乙
(2)丙方法中食盐水中的水也能使无水CuSO4变蓝,丁方法中采用稀硫酸、食盐水和MnO2加热不反应
(3)加热蒸发 有白色固体析出的是食盐水
(或测两种液体的导电性,导电能力强的为食盐水)
17.(6分)请简要叙述下图所示的实验装置、方法、操作中存在的错误.
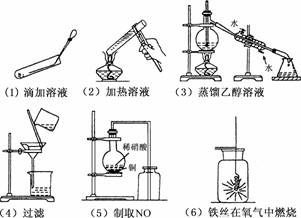
(1)________________________________;
(2)________________________________;
(3)________________________________;
(4)________________________________;
(5)________________________________;
(6)________________________________.
解析:(1)向试管中滴加液体时,试管要竖直,滴管要垂直悬空.
(2)给试管中液体加热时,液体体积不能超过试管容积的,加热时,应用酒精灯的外焰加热.
(3)蒸馏时,温度计水银球应在蒸馏烧瓶的支管口处.
(4)过滤时玻璃棒下端放在三层滤纸处.
(5)NO不能用排空气法收集,只能用排水法.
(6)铁丝在氧气中燃烧时,应在瓶底铺层细沙或瓶中放少量水.
答案:(1)试管没竖直;滴管口接触管壁
(2)试管底部放在酒精灯焰芯上;试管内液体体积不能超过试管容积的1/3
(3)温度计的水银球插在乙醇溶液中
(4)玻璃棒没有接触滤纸三层的一边
(5)不能用排空气法收集NO
(6)瓶底没有铺一层细沙或瓶里没有加少量水
16. (2009·广州二中等六校联考)下列叙述正确的是
( )

A.为提醒人们在使用浓H2SO4时要注意安全,贮存浓H2SO4的容器上贴有右图标识
B.实验室可通过蒸馏的方法除去自来水中含有的Cl-等杂质制蒸馏水
C.做焰色反应实验时,应先将铂丝(或铁丝)用稀硫酸洗净后,在酒精灯外焰上灼烧至没有颜色时,再蘸取待检溶液进行实验
D.由于碱金属单质化学性质活泼,实验室中的各种碱金属单质均保存在煤油中
解析:浓H2SO4具有强腐蚀性,而非剧毒品,A错误;通过蒸馏可以得到纯净的蒸馏水,B正确;做焰色反应实验时,铂丝应用稀HCl清洗,不能用稀H2SO4,C错误;碱金属中锂比煤油的密度小,应用石蜡密封,D错误.
答案:B
第Ⅱ卷 (非选择题,共52分)
15.用CuSO4·5H2O配制0.1 mol/L CuSO4水溶液,下面所列的方法正确的是
( )
A.取25 g CuSO4·5H2O溶于1 L水中
B.将CuSO4·5H2O干燥去掉结晶水,取16 g溶于水制成1 L溶液
C.将25 g CuSO4·5H2O溶于水制成1 L溶液
D.取12.5 g CuSO4·5H2O溶于500 mL水中
解析:CuSO4·5H2O的摩尔质量是250 g/mol,25g CuSO4·5H2O的物质的量是0.1 mol.将其溶解到水中,配成1 L溶液,即得0.1 mol/L的CuSO4溶液.将25 g CuSO4·5H2O溶在1 L水中或将12.5 g CuSO4·5H2O溶在500 mL水中,溶液的体积都不是1 L或500 mL,所得溶液浓度不是0.1 mol/L.将CuSO4·5H2O干燥去掉结晶水后得CuSO4,但由于CuSO4·5H2O干燥去掉结晶水时不知何时结晶水完全去掉,无法保证所取固体为纯CuSO4,此法不正确,且此法不符合最简单原则.
答案:C
14.下列叙述中正确的是
( )
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,1 g H2和14 g N2的体积相同;
③28 g CO的体积为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤在同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比.
A.①②③ B.②⑤⑥
C.②③⑥ D.④⑤⑥
解析:标准状况下H2O不是气体,而HCl为气体,所以虽然二者等体积,但物质的量不相同,①错误;同样在④中所指的物质不一定是气体,所以④错误;标准状况下,1 g H2和14 g N2的物质的量均为0.5 mol,故体积相同,②正确;③中28 g CO的物质的量是1 mol,但条件不确定,所以不一定是22.4 L,③错误;在同温同体积时,气体的压强与物质的量成正比,所以物质的量越大,则压强越大,⑤正确;同温同压下,气体的密度与其相对分子质量成正比,⑥正确,故选B.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com