
题目列表(包括答案和解析)
8.某溶液中大量存在以下五种离子:NO、SO、Fe3+、H+、M,其物质的量之比为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能为
( )
A.Fe2+ B.Mg2+ C.CO D.Ba2+
解析:根据电荷守恒可知M为+2价的阳离子,由于原溶液中存在SO,根据离子共存知,其中不可能含有Ba2+,又因原溶液中含有NO和H+,使溶液具有强氧化性,所以原溶液中不可能存在Fe2+和CO.
答案:B
7.欲配制100 mL 1.0 mol/L Na2SO4溶液,正确的方法是
( )
①将14.2 g Na2SO4溶于100 mL水中
②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①② B.②③ C.①③ D.①②③
解析:100 mL 1.0 mol/L的Na2SO4溶液是指在100 mL溶液中含有0.1 mol Na2SO4;①中n(Na2SO4)=0.1 mol,但溶液的体积不一定是100 mL;②中,n(Na2SO4)=n(Na2SO4·10H2O)==0.1 mol,溶液体积为100 mL,符合题意;③中,n(Na2SO4)=0.02 L×5.0 mol/L=0.1 mol,溶液体积为100 mL,符合题意.
答案:B
6.有A、B两种硫酸溶液,A溶液硫酸的质量分数为5a%,B溶液硫酸的质量分数为a%,将A、B两溶液等体积混合后,所得硫酸溶液中硫酸的质量分数为
( )
A.小于3a% B.等于3a%
C.大于3a% D.无法确定
解析:对于H2SO4而言,浓度大则密度大,因此不同质量分数的两溶液等体积混合时,所得混合溶液的质量分数大于它们和的一半,即大于3a%,故选C.
答案:C
5.某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g.若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是
( )
A.30% B.×100%
C.26.5% D.×100%
解析:关键要判断所得溶液是否饱和.若为饱和,则温度一定,溶质的质量分数不变;若为不饱和,则溶质的质量分数发生变化.先计算若3.5 g NaCl能溶于6.5 g H2O,所得溶液质量分数为×100%=35%>26.5%.由此可知,加入的NaCl并不能完全溶解,所得溶液仍为饱和溶液.
答案:C
4.一定量的质量分数为14%的KOH溶液,若蒸发掉100 g水后,其质量分数变为28%,体积为125 mL,则浓缩后的KOH溶液的物质的量浓度为
( )
A.2.2 mol/L B.4 mol/L
C.5 mol/L D.6.25 mol/L
解析:设浓缩后溶液的质量为m,据蒸发前后溶质的质量不变列出方程:
(m+100 g)×14%=m×28% m=100 g,
故原溶液中溶质质量m′=200 g×14%=28 g,
n(KOH)==0.5 mol,
则c===4 mol/L,选B.
答案:B
3.精确配制一定物质的量浓度的NaOH溶液,下面实验操作中正确的是
( )
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
解析:A错误,称量NaOH时需放在玻璃器皿中称量,因NaOH有腐蚀性;B错误,应先将称好的NaOH放入烧杯中溶解,再转移至容量瓶;C错误,NaOH在烧杯中溶解待冷却至室温后方可转入容量瓶中;D正确,容量瓶未干燥对结果无影响.
答案:D
2.关于0.2 mol/L的NaOH溶液,下列说法不正确的是
( )
A.100 mL该溶液中含0.8 g NaOH
B.200 mL该溶液与100 mL 0.2 mol/L的硫酸溶液反应形成中性溶液
C.100 mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+
D.配制含1 L水的该溶液,需NaOH的质量为8 g
解析:A项中,m(NaOH)=0.2 mol/L×0.1 L×40 g/mol=0.8 g,正确;
B项,2NaOH+H2SO4===Na2SO4+2H2O,所以==2∶1,符合化学方程式的化学计量数之比,正确;C项,N(Na+)=0.2 mol/L×0.1 L×6.02×1023 mol-1=0.02×6.02×1023,正确;D项,含1 L水的这种溶液,溶液的体积肯定不是1 L,NaOH的质量就不能以1 L溶液来计算了,错误.
答案:D
1.下列有关物理量相应的单位表达错误的是
( )
A.摩尔质量g/mol B.气体摩尔体积L/mol
C.溶解度g/100 g D.密度g/cm3
解析:本题考查的是化学常用物理量的单位.溶解度的单位是g,故C错误.
答案:C
13.下图是某化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图.其中装置Ⅰ为甲同学设计.
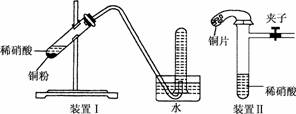
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为________.
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是________.于是他设计装置Ⅱ,其中装铜片的是气球.
(3)如何检验装置Ⅱ的气密性?
____________________________.
(4)该化学研究性学习小组的其他同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,还是会出现三个问题,需要作相应改进措施.请你帮助他们填写相关内容.
问题一:________________________;
措施:加热或____________________.
问题二:试管中的气体是淡棕红色,而不是无色;
措施:________________(填具体操作,不能增加装置).
问题三:________________________;
措施:__________________________.
解析:(1)Cu与稀HNO3反应的离子方程式为3Cu+8H++2NO===2NO↑+Cu2++4H2O.
(2)若反应生成NO2,因NO2也能与水发生反应而产生NO:3NO2+H2O===2HNO3+NO,故无法证明生成的NO源于Cu与稀HNO3所生成.
(3)检查装置Ⅱ的气密性,需先关闭夹子,形成密闭体系,然后用酒精灯稍加热试管,气球鼓起,撤掉酒精灯后,气球恢复原貌,表明装置不漏气.
(4)问题一:反应速率较慢.相应改进措施为加热或将铜片改为Cu粉.问题二:试管中的气体是淡棕红色,而不是无色,原因是装置中含有空气,空气中的氧气与NO作用生成了NO2.相应改进措施为先将少量碳酸盐倒入试管,然后迅速系上装有铜片的小气球.
答案:(1)3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(2)因为NO2与水反应也可产生NO:3NO2+H2O===2HNO3+NO,故不能证明生成的NO气体是来自于铜与稀硝酸反应
(3)关紧夹子,用酒精灯稍加热试管,气球鼓起,撤掉酒精灯后,气球恢复原貌,表明装置不漏气(或其他合理答案)
(4)反应速率较慢 将铜片改为Cu粉
先将少量碳酸盐倒入试管,然后迅速系上装有铜片的小气球 实验会造成空气污染
连接导管,将导管插入装有NaOH溶液的试管中,并向试管中持续通入空气(其他合理答案只要问题与措施一致即可)
12.氧化铜有多种用途,如用做玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜
工业CuSO4CuSO4溶液CuSO4·5H2O―→……―→CuO
①步骤Ⅰ的目的是除去不溶性杂质.操作是__________________________.
②步骤Ⅱ的目的是除铁.操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.控制溶液pH=3.5的原因是__________________________.
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是____________、过滤、水浴加热烘干.水浴加热的特点是__________________.
(2)探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡.结论是____________.
②为探究试管A中反应的速率,收集气体并测定其体积,必需的实验仪器有______________________.
解析:(1)①步骤Ⅰ的目的是除去不溶性杂质,需过滤.
②控制溶液pH=3.5,使Fe3+完全水解生成Fe(OH)3沉淀,而Cu2+不会转化为Cu(OH)2沉淀,便于除杂.
③由溶液得到晶体,可对CuSO4溶液蒸发结晶,水浴加热的优点是受热均匀且便于控制温度.
(2)①根据CuO能加快H2O2的分解,可得出CuO可作该反应的催化剂.
②可利用单位时间内收集到气体的多少来探究A中的反应速率.
答案:(1)①加适量的水溶解、搅拌、过滤 ②可使Fe3+全部转化为Fe(OH)3沉淀,而Cu2+不会转化为Cu(OH)2沉淀 ③将CuSO4溶液加热蒸发至有晶体出现时,停止加热 受热均匀,温度易于控制在100℃以下
(2)①CuO可加快H2O2分解的反应速率,是H2O2分解反应的催化剂 ②秒表、橡皮塞、导管、集气瓶、量筒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com