
题目列表(包括答案和解析)
5.体积为1 L的干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082.将此气体倒扣在水中,进入容器中液体的体积是
( )
A.0.25L B.0.5 L
C.0.75 L D.1 L
解析:=D·(O2)=1.082×32=34.6<Mr(HCl)=36.5,故该混合气体中必混有空气.HCl易溶于水,空气不溶于水,故进入容器中液体的体积等于HCl气体的体积.设HCl气体的体积为x,则空气的体积为(1 L-x).
根据气体平均摩尔质量计算公式:
4.下列条件中,两种气体所含原子数一定相等的是
( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO
D.同压强、同体积的N2O和CO2
解析:因为N2和CO具有相同的摩尔质量,所以两者质量相同时物质的量也相同,分子个数应相同,又因两者都是双原子分子,故原子个数也相等,A项正确;同温、同体积时,气体的物质的量之比等于压强之比,B选项中没有提到压强,所以分子个数不一定相等,B项错误;体积相同、密度相等,所以质量相等,C2H6和NO的摩尔质量也相等,所以分子个数相等,但由于它们的分子组成不同,所以原子个数不相等,C项错误;同压强、同体积时,由于没有说明温度,所以两种气体的物质的量不一定相等,因此D项错误.
答案:A
3.在一定温度和压强下,1 L X气体和1 L Y气体完全反应后生成1 L水蒸气和1 L氮气,X、Y两种气体是
( )
A.H2、N2O4 B.H2、N2O2
C.H2、N2O D.H2、NO2
解析:应用阿伏加德罗定律的推论(在相同温度和压强下,气体的体积之比等于其物质的量之比)和原子守恒即得出X、Y分别为H2与N2O.故C正确.
答案:C
2.(2009·广东单科高考,6)设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
( )
A.1 mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3nA个氢原子
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA个Fe3+
解析:A项,1mol硫酸钾中阴离子所带电荷数为2nA.B项,应含有4nA个氢原子.D项,由于Fe3+水解,所得溶液含有的Fe3+个数小于0.1nA.
答案:C
1.下列叙述正确的是
( )
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
解析:A项必须指明是气体.B项正确.C项未指明温度和压强,无法比较.D项强酸还分多元酸和一元酸,如等体积、等物质的量浓度的H2SO4和HCl所含的H+数不相等,故A、C、D均不正确.
答案:B
13.下图为某市售盐酸试剂瓶标签上的部分数据.问:
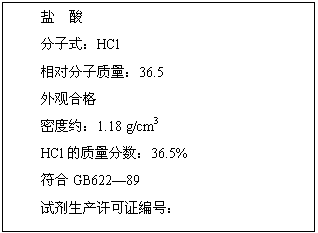
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取该盐酸25.5 mL与2.00 mol/L的氢氧化钠溶液100 mL混合,再将混合后溶液稀释至1.00 L,此时溶液的pH约为多少?
解析:(1)c(HCl)=
=11.8 mol/L.
(2)n(HCl)=11.8 mol/L×0.0255 L≈0.300 mol,
n(NaOH)=2.00 mol/L×0.100 L=0.200 mol,
混合并稀释后溶液中
c(H+)==0.100 mol/L,
pH=-lgc(H+)=1.
答案:(1)c(HCl)==11.8 mol/L
(2)1
12.用18 mol/L浓硫酸配制100 mL 3.0 mol/L稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用).
A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的操作是______________________.
(3)第⑤步实验的操作是______________________.
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”或“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中________.
B.容量瓶用蒸馏水洗涤后残留有少量的水________.
C.所用过的烧杯、玻璃棒未洗涤________________.
D.定容时俯视溶液的凹液面____________________.
解析:(1)稀释前后溶质的物质的量相等,由V(H2SO4)×18 mol/L=100 mL×10-3×3.0 mol/L,得V(H2SO4)=16.7 mL,量筒大小尽量与所盛的液体的体积相近,故选用B.
(2)第③步是浓硫酸的溶解,由于其溶于水时放出大量的热,故在溶解浓硫酸时要沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌.
(3)定容时的关键是加入的蒸馏水不能超过容量瓶颈上的刻度线,否则就必须重配.故在接近刻度线1 cm-2 cm处,改用胶头滴管向容量瓶滴加至凹液面与刻度线相切为止.塞紧瓶塞,倒转摇匀.
(4)选项A由于浓硫酸变稀,故所配制的稀硫酸浓度偏小;选项B容量瓶中残留有少量的水,对配制的稀硫酸的浓度无影响;选项C由于烧杯、玻璃棒未洗涤,上面粘有的硫酸没有转移到容量瓶中,故所配制的稀硫酸浓度偏小;选项D定容时俯视溶液的凹液面,把容量瓶中的体积读大了,即加入蒸馏水的量少了,故所配制的稀硫酸浓度偏大.
答案:(1)16.7 mL B
(2)先向烧杯中加入30 mL蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌
(3)继续向容量瓶注入蒸馏水至离刻度线1 cm-2 cm处,改用胶头滴管向容量瓶滴加至凹液面与刻度线相切为止.塞紧瓶塞,倒转摇匀
(4)A.偏小 B.无影响 C.偏小 D.偏大
11.实验室配制100 mL 1 mol/L的NaOH溶液.
(1)必需要用到的玻璃仪器有________.
(2)若实验中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应________;向容量瓶中转移溶液时,忘记了洗涤小烧杯和玻璃棒就加了部分蒸馏水(未到刻度),应____________________.
(3)要配制浓度约为2 mol/L NaOH溶液100 mL.下面的操作正确的是________(填代号).
A.称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水到刻度线,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中.
解析:(1)配制NaOH溶液,用到的玻璃仪器有烧杯、玻璃棒、100 mL容量瓶、胶头滴管.
(2)配制时加蒸馏水超过刻度线,必须重新配制;若忘记洗涤,可重新洗涤,但转移完洗涤液的体积不能超过刻度线.
(3)配制大约2 mol/L的NaOH溶液,可把体积近似相加等于100 mL即可,A、D都行,但量筒和容量瓶不能溶解固体,B、C错误.
答案:(1)烧杯、玻璃棒、100 mL容量瓶、胶头滴管
(2)重新配制 重新洗涤并转移洗涤液但不应超过刻度线
(3)AD
10.V mL密度为ρ g/mL的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为c mol/L,那么下列关系式正确的是
( )
A.m= B.c=
C.W%=% D.c=
解析:由w=,m(aq)=ρV得m(溶质)=ρ g/mL×V mL×W%,即m=,A项不对.据c=可知c==,B项不对.由c=得W%=×100%=%,C项不对.据c=,n=可知c=,即c=,D项正确.
答案:D
9.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol/L,c(SO)=0.8mol/L,则c(K+)为
( )
A.0.15mol/L B.0.2 mol/L
C.0.3mol/L D.0.4mol/L
解析:pH=1可知c(H+)=0.1mol/L,根据电荷守恒:c(H+)+3c(Al3+)+c(K+)=2c(SO)可得c(K-1)=2c(SO)-c(H+)-3c(Al3+)=2×0.8-0.1-3×0.4=0.3(mol/L).
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com