
题目列表(包括答案和解析)
2.全部可用浓硫酸干燥的一组气体是
( )
A.CH4、H2、CO、NH3
B.CO2、H2、SO2、Cl2
C.CO、CH4、HCl、HBr
D.SO2、CO2、H2、H2S
解析:A中NH3为碱性气体,不能用浓H2SO4干燥,C中HBr是还原性气体,能被浓H2SO4氧化,D中H2S也是还原性气体,也能被浓H2SO4氧化,因此只有B正确.
答案:B
1. 世界第一大佛像--乐山大佛脸上出现了黑色条纹,鼻子已经变黑,胸部和腿部也出现好几块大“伤疤”(如图).一些专家认为,出现这种现象的根源是大佛所在地自然环境湿度大、降水丰沛,容易产生风化现象,以及大佛面部微生物的新陈代谢和酸雨等各种因素的综合反应.下列有关叙述正确的是
世界第一大佛像--乐山大佛脸上出现了黑色条纹,鼻子已经变黑,胸部和腿部也出现好几块大“伤疤”(如图).一些专家认为,出现这种现象的根源是大佛所在地自然环境湿度大、降水丰沛,容易产生风化现象,以及大佛面部微生物的新陈代谢和酸雨等各种因素的综合反应.下列有关叙述正确的是
( )
A.岩石的风化过程属于物理变化
B.化石燃料燃烧排放出的CO2会引发酸雨
C.pH在5.6-7.0之间的降水通常称为酸雨
D.若黑色部分为硫化物所致,可用双氧水擦洗漂白
解析:自然风化指岩石与空气、水、二氧化碳等物质长期作用,发生了复杂的化学反应;酸雨主要由二氧化硫、氮氧化物引起;双氧水具有强氧化性,可将硫化物氧化为白色硫酸盐,故D项正确.
答案:D
13.(1)一定温度、压强下,一盛满NO2的试管倒置于盛足量水的水槽里,充分反应后试管中水的体积占试管容积的________.
(2)相同状况下,30 mLN2和NO2的混合气体通入倒立于水槽里盛满水的量筒中,剩余气体16 mL,则原混合气体中N2与NO2的体积比是________.
(3)NO和NO2盛满一试管倒置于盛足量水的水槽里,气体体积缩小为原来的3/5,则二者体积比是________.
(4)一定条件下,将等体积的NO和NO2混合气体充满试管,倒置于盛足量水的水槽里,充分反应后,剩余气体的体积为原总体积的________.
(5)一定条件下,将等体积的O2和NO混合气体充满试管,倒置于盛足量水的水槽里,充分反应后,剩余气体的体积为原总体积的________.
(6)一定条件下,将等体积的O2和NO2混合气体充满试管,倒置于盛足量水的水槽里,充分反应后,剩余气体的体积为原总体积的________.
解析:(1)3NO2+H2O===2HNO3+NO
3 1
最后剩余1体积的NO.
(2)3NO2+H2O===2HNO3+NO ΔV
3 1 2
V(NO2) (30 mL-16 mL)
V(NO2)=21 mL,V(N2)=9 mL
V(N2)∶V(NO2)=3∶7
(3)同(2)利用差量法计算.
(4)设NO和NO2的体积都为V.
3NO2+H2O===2HNO3+NO
3 1
V
则V(余)∶V(原)=(V+)∶2V=2∶3
(5)设NO和O2都为V.
4NO+3O2+2H2O===4HNO3
4 3
V V
V(余)∶V(原)=(V-V)∶2V=1∶8
(6)同(5)解法.
答案:(1) (2)3∶7 (3)2∶3 (4) (5) (6)
12.下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C.H可用作工业上冶炼金属的还原剂.请按要求填空:
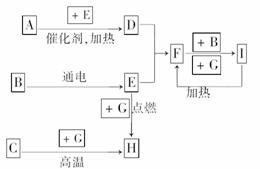
(1)写出下列物质的化学式:
A:________;B:________;C:________.
(2)写出F+B―→I的化学方程式________________________________.
(3)写出G和I的浓溶液反应的化学方程式______________________________________.
解析:液体B能被电解说明B是H2O,则E是H2或O2,又根据气体A与E反应条件是催化剂加热、反应产物D又和E反应生成F可确定E是O2,A是NH3,从而确定D是NO,F是NO2,F与B反应生成的I是HNO3.固体单质G能与I(HNO3)在加热条件下反应生成F(NO2)、B(H2O)和C,C是一种气体,猜测G是C(碳),C是CO2;CO2与C在高温下反应生成H(CO),G(C)与E(O2)反应也可生成H(CO),而CO可用作还原剂在工业上冶炼铁等金属,可以确定G是C(碳).
答案:(1)NH3 H2O CO2
(2)3NO2+H2O===2HNO3+NO↑
(3)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
11.盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为________________________________________________________.
 某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
(2)在一定体积的18 mol/L的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积________(填“>”“=”或“<”)100 mL.
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?________(填“可行”或“不可行”).
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?________(填“同意”或“不同意”),原因是______________________________________.
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,简述实验方案、实验现象及由此得出的结论:__________________________________________________________________________.
解析:根据题意不难完成问题(1)中的化学方程式,又因铜与盐酸不反应,故应想到电解方法.问题(2)中因浓硫酸浓度变小时不能再与铜反应,故易解答.问题(3)中则应从改变二氧化氮浓度的角度分析.
答案:(1)Cu+H2O2+2HCl===CuCl2+2H2O
作图:以铜为阳极,以盐酸为电解质溶液的电解池装置.
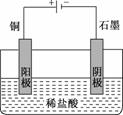
(2)> 可行
(3)不同意 等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,溶液中Cu2+的浓度基本相等 将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则该同学的结论正确,反之,不正确.(其他合理答案也对)
10.NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情,病毒学研究同时证实,NO对SARS病毒有直接抑制作用.下列关于NO的叙述正确的是
( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的质量相等
D.NO难溶于水,可以用排水法收集
解析:NO是一种无色难溶于水的气体,可以用排水法收集;常温常压下,NO容易与氧气直接化合生成NO2.
答案:D
9.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
( )
A.60 mL B.45 mL
C.30 mL D.15 mL
解析:由题意可知:HNO3CuO2,由图分析可得:Cu失去的电子数与O2得到的电子数相等,即n(Cu)=2n(O2)=2×=0.15 mol.根据质量守恒及NaOH和Cu(NO3)2的反应可得关系式:n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3 mol,则V[NaOH(aq)]==0.06 L=60 mL.
答案:A
8.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现.使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一.下列有关说法不正确的是
( )
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
解析:根据题意可以得出,该反应为2xCO+2NOx===2xCO2+N2(铂催化),由此可以判断A、B、C正确;能与血红蛋白结合的有毒气体是CO和NO,故D错误.
答案:D
7.将Mg、Cu组成的2.64 g混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到的还原产物NO气体0.896 L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液60 mL时金属离子恰好沉淀完全.则形成沉淀质量为
( )
A.4.32 g B.4.68 g
C.5.36 g D.6.38 g
解析:Mg、Cu均为二价金属,2.64 g金属生成氢氧化物实际是增加了OH-的质量,故m(OH-)=2 mol/L×0.06 L×17 g/mol=2.04 g,所以沉淀质量为2.64 g+2.04 g=4.68 g.
答案:B
6.常温下,下列溶液中一定能大量共存的离子组是
( )
A.在pH=1的溶液中:Na+、Fe2+、Cl-、NO
B.在pH=7的溶液中:Fe3+、Mg2+、Cl-、NO
C.由水电离出的c(H+)=10-14 mol/L溶液中:Na+、K+、SO、NO
D.在无色透明溶液中:Al3+、Na+、Cl-、S2-
解析:A项中H+、Fe2+、NO不共存,A项错.pH=7时,Fe3+已沉淀完全,故B项错.D项中2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑,故D项错.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com