
题目列表(包括答案和解析)
12.某同学用如图1所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先变浑浊后变澄清的现象,但通入SO2看不到浑浊现象.
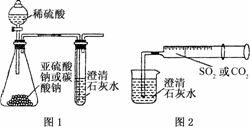
经思考后该同学改用图2所示的装置,将气体收集在注射器内,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再变澄清的现象,且通入SO2时产生现象的速度明显比通入CO2快.
(1)对比分析两组实验,你认为用图1所示装置进行实验时,通入SO2不出现浑浊的原因可能是________________________________________________.
(2)用图2所示装置进行实验时,以相同速率通入CO2和SO2,SO2产生浑浊、澄清的现象比CO2快的原因是______________________________________________.
(3)用图1所示装置进行SO2与石灰水反应的实验若存在缺陷,其改进方法是(若你认为该装置没有缺陷,此空可以不填)_______ ______________________.
解析:(1)由于制取装置产生SO2的速度快,SO2直接与Ca(OH)2生成了可溶性的Ca(HSO3)2,因而看不到沉淀.
(2)由于SO2的溶解度大,因而与石灰水反应也快,同时生成的亚硫酸的酸性比碳酸强,所以SO2产生先变浑浊再变澄清的现象更快.
(3)SO2能污染环境,故应用NaOH溶液吸收.
答案:(1)制气装置产生SO2的速度快,SO2直接与Ca(OH)2生成了可溶于水的酸式盐Ca(HSO3)2,因而看不到沉淀
(2)SO2溶解度大,因而与石灰水反应也快,同时生成的亚硫酸的酸性比碳酸强
(3)用导管将尾气通入NaOH溶液中
11.下列过程中,最终的白色沉淀不一定是BaSO4的是
( )
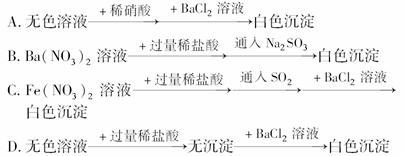
解析:先加稀HCl可排除CO、SO的干扰,加入稀盐酸后无沉淀说明溶液中不存在Ag+等阳离子,再加入BaCl2生成白色沉淀,可以肯定原溶液中存在SO.
答案:A
10.(2009·太原质检)在BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛两支试管,一支加硝酸,另一支加烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀.由此得出下列结论合理的是
( )
A.氯化钡显两性
B.两支试管中生成的沉淀都是BaSO4
C.两支试管中的沉淀都是BaSO3
D.H2SO3可被HNO3氧化为H2SO4,BaCl2与SO2不反应,但能与SO反应
解析:在BaCl2溶液中通入SO2,溶液仍然澄清,这是实验事实.因为如果发生反应:BaCl2+SO2+H2O===BaSO3↓+2HCl,一是出现弱酸(H2SO3)制强酸HCl,违反规律,二是即使生成BaSO3沉淀它也溶于盐酸,故BaCl2与SO2不反应,溶液仍澄清.若将BaCl2溶液分成两份,一份加硝酸,再通入SO2,可以发生将SO2或SO氧化成SO,此时发生Ba2++SO===BaSO4↓;另一份加烧碱溶液,再通入SO2,先发生SO2+2NaOH===Na2SO3+H2O,再发生BaCl2+Na2SO3===BaSO3↓+2NaCl.综上所述,A、B、C不正确;D中SO2能被硝酸氧化和与NaOH溶液反应证明其有还原性和酸性,加碱后SO2Na2SO3,SO浓度加大,与Ba2+结合生成BaSO3沉淀,故D正确.
答案:D
9.(2009·衡水中学高三调研)下列有关SO2的说法中,错误的是
( )
A.SO2能漂白某些物质,说明它具有氧化性
B.SO2水溶液能使紫色石蕊试液变红,说明它能与水反应生成H2SO3
C.将足量SO2通入酸性KMnO4溶液,溶液褪色,说明SO2具有还原性
D.实验室可用浓H2SO4干燥SO2
解析:SO2具有漂白性,能漂白某些有色物质,溶于水与水反应生成H2SO3而使紫色石蕊试液变红,具有还原性,能将高锰酸钾还原而使溶液褪色,但能用浓H2SO4干燥.
答案:A
8.把一定量的SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.在上述一系列变化过程中,最终被还原的是
( )
A.SO2 B.Fe2+
C.NO D.Fe3+
解析:当SO2通入溶液中时,SO2与水反应生成亚硫酸,电离出氢离子,NO在酸性环境下具有强氧化性,能将亚硫酸根离子或SO2氧化为硫酸根离子,而本身则被还原.
答案:C
7.在下图所示的实验装置中,实验开始一段时间后,观察到的现象不正确的是
( )
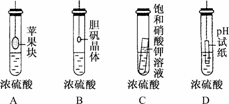
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出
D.pH试纸变红
解析:浓硫酸具有吸水性,会吸收试管内空气中的水蒸气,造成空气中水分减少,苹果块、胆矾晶体、饱和硝酸钾溶液均会失水,导致苹果块干瘪、胆矾晶体表面有“白斑”、小试管内有晶体析出,浓硫酸具有脱水性会使pH试纸炭化变黑.
答案:D
6.向50 mL18mol/L的H2SO4中加入足量的Cu并加热,被还原的H2SO4的物质的量是
( )
A.等于0.9 mol
B.大于0.45 mol,小于0.9 mol
C.等于0.45 mol
D.小于0.45 mol
解析:Cu与稀硫酸不反应,在加热条件下铜和浓硫酸发生反应的化学方程式为:
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
参加反应的浓H2SO4有一半被还原,在Cu与浓H2SO4的反应过程中,浓硫酸浓度逐渐降低,变成稀H2SO4时反应会停止,所以0.9 molH2SO4与足量铜片反应时,被还原的H2SO4小于0.45 mol.
答案:D
5.(2009·烟台质检)区别SO2和CO2气体可选用
( )
A.通入澄清石灰水中
B.通入品红溶液中
C.用带火星木条检验
D.通入石蕊试液中
解析:CO2和SO2有一些相似的性质,如水溶液都显酸性,都可与Ca(OH)2溶液反应生成难溶物,都不能助燃等;也有一些明显的性质差异,突出的是SO2具有漂白作用,具有较强的还原性等,而CO2则不具备这些性质,所以本题答案为B.
答案:B
4.标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是
( )
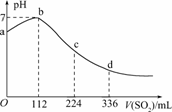
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
解析:H2SH++HS-,溶液显酸性.当通入SO2时,SO2+2H2S===3S↓+2H2O,即ab段发生的反应,A项正确.溶液酸性减弱,导电性减弱,D项错误.当通入112 mL SO2时恰好反应完全,所以c(H2S)===0.1 mol/L,C项错误.继续通入SO2,SO2+H2O===H2SO3,H2SO3H++HSO,由图象知,d点比a点pH小,即等物质的量浓度的H2SO3比H2S的电离程度大,H2SO3比H2S酸性强,B项错误.
答案:A
3.浓硫酸和2 mol/L的稀硫酸在实验室中敞口放置.它们的质量和放置天数的关系如下图,分析a、b曲线变化的原因是
( )
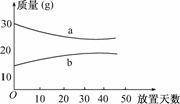
A.a升华、b冷凝
B.a挥发、b吸水
C.a蒸发、b潮解
D.a冷凝、b吸水
解析:考查浓硫酸和稀硫酸的性质.浓硫酸具有很强的吸水性,而稀硫酸易挥发出水分.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com