
题目列表(包括答案和解析)
9.某无色溶液中可能含有I-、NH、Cu2+、SO,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是
( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO ④可能含有I-
A.①③ B.①②③
C.③④ D.②③④
解析:原溶液为无色溶液说明肯定不含Cu2+;由于亚硫酸根离子的还原性强于碘离子,因此加入的少量溴水先和亚硫酸根离子反应,离子方程式为:SO+Br2+H2O===SO+2Br-+2H+,反应后溶液呈无色,因此③和④也正确.
答案:D
8.CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
( )
A.Cs显+3价,I和Cl均显-1价
B.Cs显+1价,Cl显+1价,I显-1价
C.在CsICl2溶液中通入氯气,有单质碘生成
D.在CsICl2溶液中通入SO2,有硫酸生成
解析:Cs为第ⅠA族,化合价为+1价,因Cl的非金属性强于I,故I为+1价,Cl为-1价,又因I的价态较高,故该化合物具有较强的氧化性,所以只有D正确.
答案:D
7.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO的浓度之比为1∶3,则Cl2与NaOH溶液反应时参加反应的Cl2与被氧化的氯气的物质的量之比为
( )
A.21∶5 B.11∶3
C.3∶1 D.5∶1
解析:设ClO-和ClO分别为1 mol和3 mol,则被氧化的Cl2为2 mol,再根据电子得失守恒,被还原生成Cl-的Cl2共为(1+3×5)/2=8 mol,参加反应的Cl2共8 mol+2 mol=10 mol.所以选D.
答案:D
6.氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O===HBrO+HCl.下列有关BrCl的性质的叙述中不正确的是
( )
A.是较强的氧化剂
B.是一种化合物
C.能使湿润的淀粉碘化钾试纸变蓝
D.BrCl与水反应中,BrCl既是氧化剂又是还原剂
解析:BrCl的化学性质与Cl2相似,应是较强的氧化剂,可氧化KI生成I2,I2遇淀粉变蓝.BrCl由两种元素组成,显然属于化合物.BrCl分子中,Cl原子吸引电子的能力强,故电子对偏向Cl,使Cl显-1价,Br显+1价,根据反应BrCl+H2O===HBrO+HCl,BrCl中各元素化合价未变,故此反应不是氧化还原反应.
答案:D
5.下列离子方程式书写错误的是
( )
A.氯气与水反应:
Cl2+H2O
 2H++Cl-+ClO-
2H++Cl-+ClO-
B.氯水滴加到AgNO3溶液中:
Cl-+Ag+===AgCl↓
C.碳酸钙与盐酸反应:
CaCO3+2H+===Ca2++H2O+CO2↑
D.用氢氧化钠溶液吸收氯气:
Cl2+2OH-===Cl-+ClO-+H2O
解析:在Cl2与水的反应中,生成的HClO是弱酸,不可拆开,正确的应为Cl2+H2OH++Cl-+HClO.
答案:A
4.氯气是一种重要的工业原料.工业上利用反应:3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气.下列说法错误的是
( )
A.若管道漏气则遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 molN2有6 mol电子转移
解析:根据题给反应知,其产物HCl遇NH3生成白色固体NH4Cl,A正确;从方程式看Cl元素化合价降低,氮元素化合价升高,所以Cl2为氧化剂,B正确;且生成1 molN2时,转移6 mol电子,故D正确;根据复分解反应的定义,C错误.
答案:C
3.氰气分子式为(CN)2,其性质与卤素相似,在化学上称为类卤化合物,以下关于(CN)2的叙述不正确的是
( )
A.可与活泼金属直接发生化学反应
B.易溶于水也易溶于NaOH溶液
C.是一种有毒气体
D.可用HCN溶液与MnO2混合加热制取
解析:卤素在水中溶解度不大,其他几种说法都可根据氯元素对应的性质进行判断.
答案:B
2.下列溶液能使红色花瓣快速褪色的是
( )
A.稀盐酸 B.新制氯水
C.氯化钙稀溶液 D.生理盐水
解析:能使花瓣快速褪色的只有新制氯水,因其余物质均不具有强氧化性.
答案:B
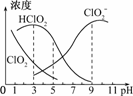
1.印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、ClO,其中HClO2是漂白剂的有效成分,ClO2是有毒气体.各组分含量随pH变化情况如图所示,由图可知 ,使用该漂白剂的最佳pH为
( )
A.3.0 B.4.0-4.5
C.6.5-7.0 D.9.0
解析:选择的原则有二:①HClO2浓度较大,②污染物浓度较小,故结合图可知B项符合条件.
答案:B
13.工业上以硫铁矿为原料制硫所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品.
请按要求回答下列问题:
(1)将尾气通入氨气中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式________________________、__________________________.
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体.①导致溶液温度降低的原因可能是____________________________;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产.已知该结晶水合物的相对分子质量为134,则其化学式为________;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是____________________________________________.
(3)能用于测定硫酸尾气中SO2含量的是________.(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液,稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
解析:(1)因尾气中含有SO2,所以通入氨水易生成H2SO3、(NH4)2SO3或NH4HSO3,从而被O2氧化.
(2)①温度自行降低,自然联想到反应吸收了热量所致.②结合SO2与氨水可能的产物与结晶水合物的相对分子质量为134,可知为(NH4)2SO3·H2O.③酚、胺类为还原性强的物质,亚硫酸盐易被氧化.
(3)尾气中含SO3和酸雾,可消耗NaOH溶液和氨水,从而影响测定SO2,而对KMnO4溶液和碘水没有影响.
答案:(1)2H2SO3+O2===2H2SO4
2(NH4)2SO3+O2===2(NH4)2SO4
2NH4HSO3+O2===2NH4HSO4(任填两个)
(2)①反应吸热 ②(NH4)2SO3·H2O
③防止亚硫酸铵被氧化
(3)BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com