
题目列表(包括答案和解析)
6.材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础.下列有关材料的说法中正确的是
( )
A.生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石
B.合金材料钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀
C.居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体
D.造成“白色污染”的聚氯乙烯塑料在日常生活中可用来进行食品包装
解析:陶瓷生产中不需要石灰石,花岗岩中释放出来的有害物质是放射性气体氡,聚氯乙烯塑料不可用于食品包装,A、C、D均错误.钢铁腐蚀的主要原因是电化学腐蚀,所形成的原电池的负极为铁,正极为碳,B正确.
答案:B
5.(2010·江苏徐州质检)将过量的CO2分别通入①CaCl2溶液;②Na2SiO3溶液;③Ca(OH)2溶液;④饱和Na2CO3溶液.最终溶液中有白色沉淀析出的是
( )
A.①②③④ B.②④
C.③④ D.②③④
解析:CO2溶于水:CO2+H2O===H2CO3,H2CO3的酸性比盐酸弱,而比硅酸强,根据酸与盐反应的规律,CO2通入CaCl2溶液无明显现象(一般弱酸不能制强酸);过量的CO2通入Na2SiO3溶液中有白色沉淀H2SiO3生成;CO2通入Ca(OH)2溶液至过量:Ca(OH)2+CO2===CaCO3↓+H2O,CaCO3+H2O+CO2===Ca(HCO3)2,最终生成Ca(HCO3)2而无沉淀产生;过量CO2通入饱和Na2CO3溶液中:Na2CO3+H2O+CO2===2NaHCO3,生成的NaHCO3的溶解度比Na2CO3的溶解度小,从而有结晶析出.
答案:B
4.(2009·江苏南通调研)从石英砂制取并获得高纯硅的主要化学反应如下:
①SiO2+2CSi(粗)+2CO↑
②Si(粗)+2Cl2SiCl4
③SiCl4+2H2Si(纯)+4HCl
关于上述反应的分析不正确的是
( )
A.①、③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
解析:选项A,根据置换反应和化合反应的概念即可判断,正确;选项B,根据反应①可知还原性焦炭大于硅,根据反应③可知还原性氢气大于硅,正确;选项C,在三个反应中,硅元素的化合价从0价变为+4价或从+4价变为0价,故每消耗或生成28 g硅,转移电子均为4 mol,正确;选项D,反应中得到的易挥发的SiCl4分离出来后再用氢气还原才可以得到高纯硅,故原操作不正确.
答案:D
3.工业制造金刚砂(SiC)的化学方程式如下:SiO2+3C===SiC+2CO↑.在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是
( )
A.3∶5 B.1∶2
C.2∶1 D.1∶1
解析:在该反应中,3 mol C参加化学反应,生成1 mol的Si和2 mol的O,所以氧化剂与还原剂均为C,且物质的量之比为1∶2,B正确.
答案:B
2.下列试剂可用带玻璃塞的玻璃瓶存放的是
( )
A.NaOH溶液 B.Na2SiO3溶液
C.盐酸 D.氢氟酸
解析:玻璃中的SiO2能与HF发生反应,与NaOH溶液作用生成具有粘合性的Na2SiO3,不与盐酸作用,故选C.
答案:C
1.(2009·潍坊高三质量检测)关于硅及其化合物的叙述中,错误的是
( )
A.硅是良好的半导体材料
B.二氧化硅能与石灰石反应:
SiO2+CaCO3CaSiO3+CO2↑
C.可以用焦炭还原二氧化硅生产硅:
SiO2+2CSi+2CO↑
D.水泥的主要成分是Na2SiO3、CaSiO3和SiO2
解析:玻璃的主要成分为Na2SiO3、CaSiO3和SiO2,水泥的主要成分为硅酸三钙、硅酸二钙、铝酸三钙,故D错误,A、B、C均正确.
答案:D
13.如图所示是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置

(1)要将C装置接入B和D之间,正确的接法是:a→________→________→d.
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯.Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____________________.为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_______________________________.
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________________________________,B的作用是________________________________________________________________.
(4)用量筒量取20 mLE中溶液,倒入已检查不漏水的分液漏斗中,然后再注入10 mLCCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,
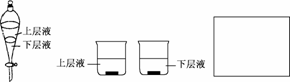
呈黄绿色的是________(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是________(填“上层液”或“下层液”).
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图______________________________________________.
解析:(1)连接的关键是C装置的作用,由于D中反应生成了CO2和HCl,有氢元素存在,说明有水参加反应,反应方程式为2Cl2+C+2H2O4HCl+CO2,C装置的作用是提供水蒸气,而且Cl2从C中出来带出水蒸气,因此应该是长进短出.(2)C中提供水蒸气,烧杯中加入浓硫酸,浓硫酸溶于水放热,有利于水蒸气生成.(3)K关闭,此时B相当于量气装置,生成的气体将B中的NaCl溶液压入漏斗中.(4)此步操作是卤素单质的萃取,Cl2易溶于CCl4,而使CCl4层呈黄绿色,Cl2无漂白性,上层液主要是Cl2和水反应生成的HCl和HClO,HClO具有漂白性,可以使有色布条褪色.(5)由于D中反应生成了极易溶于水的HCl,E装置不正确,会造成E中水倒吸,可以用一个倒置的小漏斗防止倒吸.
答案:(1)c b (2)2Cl2+C+2H2O4HCl+CO2 加入的浓硫酸溶于水能放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要 (3)瓶中液面下降,长颈漏斗内液面上升 贮存少量Cl2,避免Cl2对环境造成污染 (4)下层液 上层液 (5)D中反应生成的HCl气体极易溶于水,易发生倒吸,如图所示

12.(2009·枣庄质检)某化学研究小组的成员经过学习得知,Cl2与H2O发生下列化学反应,并且HClO具有比Cl2更强的氧化性.
Cl2+H2O
 HCl+HClO
HCl+HClO
他们为了探究新制饱和氯水的组成和性质而进行了科学实验:先观察了氯水的外观性质以后,又用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.以下的一些问题需要请你来配合回答:
(1)请写出新制饱和氯水中含有氯元素物质的化学式:____________________.
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据:____________________________________________.
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明之:
①________________________________________;
②________________________________________.
(4)他们又要通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②,在此之前先做了实验预案的设计.请你简述实验的方法、现象和结论.
解析:(1)由Cl2+H2O
 HCl+HClO可知,溶于水的Cl2,一部分转化成了HCl和HClO,另一部分以Cl2的形态溶解于水中.
HCl+HClO可知,溶于水的Cl2,一部分转化成了HCl和HClO,另一部分以Cl2的形态溶解于水中.
(2)氯水因Cl2的存在而显浅黄绿色,氯水显浅黄绿色就是其中含有Cl2的依据.
(3)溶液的红色是酚酞与NaOH相互作用的结果.若没有酚酞,NaOH溶液呈无色;若没有NaOH,酚酞溶液也呈无色.由“(1)”中的分析可知,新制的氯水中既含有以显强酸性为主的HCl,又含有以显强氧化性为主的HClO.
(4)若是氯水中的HCl中和了NaOH而使红色褪去,则溶液中还有酚酞,故可应用验证酚酞存在的方法来证明之;若是氯水中的HClO氧化了酚酞而使红色褪去,则溶液中就没有酚酞了,故可应用验证酚酞不存在的方法来证明之.
答案:(1)Cl2、HCl(或Cl-)、HClO
(2)氯水显浅黄绿色
(3)①HCl中和了NaOH ②HClO漂白(氧化)了酚酞
(4)取无色溶液3 mL盛于另一支洁净的试管中,加2滴NaOH溶液,振荡,观察现象.若溶液复现红色,则证明溶液红色褪去的原因是①而不是②;若溶液仍为无色,则证明溶液红色褪去的原因是②而不是①.
11.(1)我们每天食用的碘盐,主要成分就是由氯元素和钠元素组成的氯化物.请写出NaCl的电子式________.
(2)聚四氟乙烯与聚氯乙烯为常见的高分子化合物,它们的单体分别是________和________.
(3)漂粉精的有效成分是次氯酸钙.工业上用Cl2与石灰乳反应制备.写出该反应的离子方程式________________________________________________________.
(4)药品KBr、KI、NaI均为白色固体.若试剂瓶的标签已模糊不清,请设计实验检验出KI,完成表格.
|
|
操作 |
结论 |
|
步骤1 |
取适量固体进行焰色反应 |
|
|
步骤2 |
|
产生黄色沉淀的为KI |
解析:(1)NaCl的电子式为Na+[····]-.
(2)聚四氟乙烯、聚氯乙烯分别由CF2=CF2、CH2=CHCl加聚生成,因此CF2=CF2、CH2=CHCl分别是聚四氟乙烯和聚氯乙烯的单体.
(3)Cl2与Ca(OH)2发生反应制漂粉精的离子方程式为:
Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O.
(4)先利用焰色反应检验出NaI,再用AgNO3和稀HNO3根据反应生成沉淀的颜色不同检验KBr、KI.
答案:(1)Na+[····]-
(2)CF2=CF2
 CH2=CHCl
CH2=CHCl
(3)Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
(4)火焰呈黄色的为NaI 再取少量固体溶于水,加入HNO3酸化的AgNO3溶液
10.按下图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
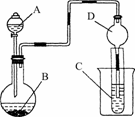
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D.实验仪器D可以起到防止倒吸的作用
解析:用MnO2与浓盐酸反应制取Cl2,反应需要加热,A错误;贝壳的主要成分为CaCO3,与醋酸反应生成的CO2会使澄清石灰水变浑浊,B正确,NH3·H2O不能溶解Al(OH)3,C错误;D有较大的容积,可起防止倒吸的作用,D正确.
答案:BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com