
题目列表(包括答案和解析)
26.(16分 )
)
实验室可由软锰矿(主要成分为MnO2)制备KmnO4,方法如下:软锰矿与过量固体KOH和KclO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4。请回答:
(1) 软锰矿制备K2MnO4的化学方程式是
;
(2)K2MnO4制备KMnO4的离子方程 式是 ;
式是 ;
( 3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KmnO4的理论产量;
3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KmnO4的理论产量;
(4)KmnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2+该反应的化学方程式是
;
(5)上述制得的KmnO4产品0.165g,恰好与0. 335g钝Na2C2O4反应完全,计算该KmnO4的纯度。
335g钝Na2C2O4反应完全,计算该KmnO4的纯度。
第26题的第(3)问和第(5)和第13题,以电解和氧化还原知识点为载体,考察考生对相关知识的掌握程度和依据有关反应式进行计算的能力。
2009年理科综合化学部分涉及到计算的题有:
13.电解100mL含 c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A.0.10mol/LAg+ B.0.02mol/L Zn2+
C.0.20mol/L Cu2+ D.0.20mol/L Pb2+
(1)由图象信息写出反应的化学方程式:
例1.某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图1,由图中的数据分析该反应的化学方程式为 。反应开始至2 min,Z的平均反应速率为 。
min,Z的平均反应速率为 。
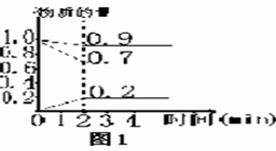
解析:化学方程式书写关键是确定反应物和生成物及它们对应的系数。一般地,反应物的量随时间不断减小,生成物则是不断增加。化学方程式各物质的化学计量系数之比等于相应物质的物质的量的变化量的比值。
(2)化学反应速率与各影响因素的关系。
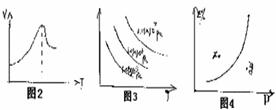
例2.把镁条投入盛有盐酸的烧杯里,产生氢气的速率可由图2,在下列因素中:①.H+浓度;②.镁条的表面积;③.溶液的浓度;④.Cl-浓度。影响反应速率的因素是()。
 A.①④B.③④.C.①②③D.②③
A.①④B.③④.C.①②③D.②③
解析:由Mg+2H+==Mg2++H2↑可知Cl--不影响反应速率,温度越高,反应速率越大;随反应的进行,H+浓度不断减小,则反映速率逐渐减慢。
(3)P、T对化学反应速率的影响:
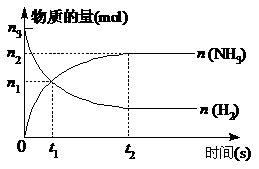
例3.如图3表示外界条件(温度、压强)的变化对下列反应L(S)+G(g)==2R(g)-Q的影响,在图中Y轴是指()
A.平衡混合物中R的体积分数B.平衡混合物中G的体积分数
C.G的转化率 D.L的转化率
解析:曲线反应的是温度、压强与Y之间的关系,且温度升高,Y减小,压强增大Y增大。根据化学方程式及选项的要求得出结论。
例4.在mA(S)+nB(g==pC(g)+Q的可逆反应中,在一定温度的条件下,B的质量分数与压强的关系如图4,有关叙述正确的是()
A.m+n<P B.n>p C.x点时,正反应速率大于逆反应速率
D.x点的反应速率比y点的小E.y点时,正反应速率大于逆反应速率
解析:由图象曲线可知:Z%随压强增大而增大,故增大压强平衡逆向移动,又因为A为固体,则n< p,故A,B均错误;x、y两点均未达到平衡状态,其中x
p,故A,B均错误;x、y两点均未达到平衡状态,其中x 点表示从正反应开始达到平衡状态前的某个状态,在一定温度和压强下,从正反应由大到小,最后达到平衡,所以正反应速率大于逆反应速率。Y点表示在一定温度和压强下,从逆反应开始;
点表示从正反应开始达到平衡状态前的某个状态,在一定温度和压强下,从正反应由大到小,最后达到平衡,所以正反应速率大于逆反应速率。Y点表示在一定温度和压强下,从逆反应开始; 从图可知,y点压强大于x点压
从图可知,y点压强大于x点压 强,则可知y点反应速率大于x点反应速率。
强,则可知y点反应速率大于x点反应速率。
(4).根据图示进行有关计算。
例5.把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2 + O2 ⇌2NO
|
温度 |
27℃ |
2000℃ |
|
K值 |
3.84×10-31 |
0.1 |
表二:N2 + 3H2 ⇌2NH3
|
温度 |
25℃ |
350℃ |
400℃ |
450℃ |
|
K值 |
5×108 |
1.847 |
0.507 |
0.152 |
(1)根据上表中的 数据分析,下列说法正确的是_________。
数据分析,下列说法正确的是_________。
a.在常温下,大气固氮几乎不可能,而工业固氮非常容易进行
b.人类大规模模拟大气固氮是无意义的
c.在常温下,大气固氮与工业固氮完成程度相差很大
d.大气固氮与工业固氮都是放热反应
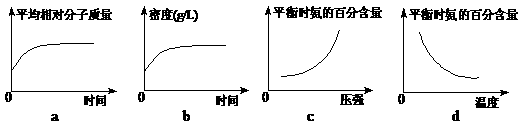
(2)在一定条件下,工业固氮在一固定体积的密闭容器中进行直至平衡, 有人画出了下列图像a和b;达到平衡后,向密闭容器中分别充入稀有气体或升高温度,有人又分别画出了如下图像c和d。其中有关图像正确的是______________(填编号)。
有人画出了下列图像a和b;达到平衡后,向密闭容器中分别充入稀有气体或升高温度,有人又分别画出了如下图像c和d。其中有关图像正确的是______________(填编号)。
(3)在一定条件下,工业固氮反应在体积为VL的
密闭容器中进行,有关图像如右图,则用H2
表示从开始到平衡时该反应的平均速率:
v=_______________________。
解析:(1) 由表中数据可得,在常温下,大气固氮的K值很小,但也可能固氮,而工业固氮的K值很大。又由表中数据分析得出,表一的平衡常数均随温度升高而增大,即均升温平衡正向移动,因此正向是吸热反应;而表二的平衡常数均随温度升高而减小,即均升温平衡逆向移动,因此正向是放热反应,所以选项bc符合题意。
(2)在一定条件下,工业固氮N2 +3H2 ⇌2NH3在一固定体积的密闭容器中进行,因为混合气体总质量不变(质量守恒定律),而总物质的量减小直至平衡,因而平均相对分子质量增大直至平衡保持不变,a正确。又因混合气体总质量不变,而容器体积不变,即气体体积也不变,所以气体的密度始终不变,b错误。达到平衡后,向密闭容器中充入稀有气体时,虽然容器内压强增大,但N2、H2、NH3的浓度(或其分压)不变,因此平衡不移动,平衡时氨的百分含量不变,故c错误。而达到平衡后,向密闭容器中升高温度,由于正反应放热,平衡逆向移动,所以平衡时氨的百分含量减小,故d正确。
(3)因为图中没有标出H2平衡时的物质的量,所以H2的浓度变化量无法求出,只能先求出NH3的速率,再根据速率之比等于化学计量数之比,求H2的速率了。在0→t2时间内,NH3的浓度变化量为n2/V mol/L,则NH3的速率为n2/Vt2 mol/(L· s),所以H2的速率为
s),所以H2的速率为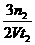 mol/(L·s)。
mol/(L·s)。
13.三硅酸镁为白色无味粉末,不溶于水和乙醇,易与无机酸反应.有关部门规定三硅酸镁样品中含水量不超过12.2%为优良级.某化学兴趣小组欲测定三硅酸镁的化学式(可用MgxSi3Oy·mH2O表示),实验步骤如下:
步骤一:取16.6 g三硅酸镁样品,充分加热至不再分解,冷却、称量,得固体13.0 g.
步骤二:另取16.6 g三硅酸镁样品,向其中加入足量100 mL 4mol/L的盐酸,充分反应后,过滤、洗涤、灼烧,得固体9.0 g.该固体为空间网状结构,且熔沸点很高.
(1)通过计算确定MgxSi3Oy·mH2O的化学式.
(2)该小组测定的三硅酸镁样品是否为优良级?
(3)写出该三硅酸镁样品与盐酸反应的化学方程式.
解析:(1)由题意知步骤二中得到的固体为SiO2,9.0 gSiO2的物质的量为0.15 mol,样品中H2O的质量为3.6 g,物质的量为0.2 mol.
设16.6 g三硅酸镁的物质的量为a
MgxSi3Oy·mH2O-3SiO2-mH2O
1 3 m
a 0.15 mol 0.2 mol
解得a=0.05 mol,m=4
MgxSi3Oy·mH2O的摩尔质量为:=332 g/mol
即24x+28×3+16y+18×4=332①
由化合物中化合价代数和为零得2x+4×3=2y②
联立①②求解得:x=2,y=8,
所求化学式为Mg2Si3O8·4H2O.
(2)样品中水的质量为16.6 g-13.0 g=3.6 g,所以样品中含水量为×100%≈21.7%>12.2%,故样品不是优良级.
(3)根据反应情况可写出该三硅酸镁样品与盐酸反应的化学方程式为:
Mg2Si3O8·4H2O+4HCl===2MgCl2+3H2SiO3↓+3H2O.
答案:(1)Mg2Si3O8·4H2O (2)否
(3)Mg2Si3O8·4H2O+4HCl===2MgCl2+3H2SiO3↓+3H2O
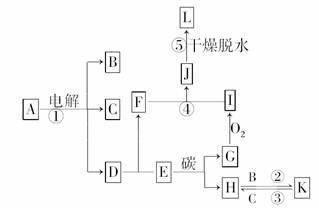
12.下图所示为物质A-K之间的转化关系,反应①为电解A的饱和溶液,是一种重要的化工反应,反应②③在工业上对某种物质的提纯具有非常重要的意义,通过④⑤反应而得到的L常用作实验室和袋装食品、瓶装食品等的干燥剂,也可以用作催化剂的载体.G、I常温下是无色气体.
请回答:
(1)B为________,G为________(写化学式).
(2)写出D、E反应生成F的化学方程式________________________________________.
(3)写出反应④的离子方程式______________________________________________.
(4)写出反应①的化学方程式______________
________________________________________.
解析:由题意:反应①为电解A的饱和溶液,是一种重要的化工反应,可推测为氯碱工业反应;反应②③在工业上对某种物质的提纯具有非常重要的意义,可推测为工业粗硅的提纯;通过④⑤反应而得到的L常用作实验室和袋装食品、瓶装食品等的干燥剂,也可以用作催化剂的载体,可推测为硅胶的制取.综上所述,不难推断图中的各种物质.
答案:(1)Cl2 CO
(2)SiO2+2NaOH===Na2SiO3+H2O
(3)SiO+CO2+H2O===H2SiO3↓+CO
(4)2NaCl+2H2O2NaOH+Cl2↑+H2↑
11.如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质).将所选答案的编号填入表内相应的空格内(如果不需要外加试剂,则对应答案栏可不填).
可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
可供选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
|
|
粉末状混合物 |
试剂 |
方法 |
|
(1) |
CaCO3(SiO2) |
|
|
|
(2) |
NaCl(SiO2) |
|
|
|
(3) |
SiO2(Fe2O3) |
|
|
|
(4) |
SiO2(CaCO3) |
|
|
|
(5) |
SiO2(H2SiO3) |
|
|
|
(6) |
SiO2(NH4Cl) |
|
|
解析:可根据二氧化硅是不溶于水的酸性氧化物,它可跟强碱反应,不跟酸(氢氟酸除外)反应,受热不分解等性质来选择,而三氧化二铁、碳酸钙跟盐酸反应;硅酸、氯化铵受热分解.通过一定操作,即可除去杂质,除杂过程中所发生的化学方程式如下:
(1)SiO2+2NaOH===Na2SiO3+H2O
(3)Fe2O3+6HCl===2FeCl3+3H2O
(4)CaCO3+2HCl===CaCl2+CO2↑+H2O
(5)H2SiO3SiO2+H2O
(6)NH4ClNH3↑+HCl↑
答案:(1)B ④ (2)D ④⑤ (3)A ④ (4)A ④ (5)③ (6)②
10.“空对空”响尾蛇导弹头部的“红外眼睛”,能分辨出0.001℃的温差变化,它是由热敏陶瓷材料和热释电陶瓷材料做成的.下列叙述中不正确的是
( )
A.“红外眼睛”对热非常敏感
B.“红外眼睛”的热目标是敌机发动机或尾部喷口高温区
C.“红外眼睛”的电阻值随温度明显变化
D.“红外眼睛”的工作原理与人眼相同
解析:由“红外眼睛”是由热敏陶瓷材料和热释电陶瓷材料做成的,可知它对热很敏感,故A、B、C正确,D不正确.
答案:D
9.(2009·广州高三调研)下列叙述不正确的是
( )
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性
D.太阳能电池可用硅材料制作,其应用有利于环保、节能
解析:金刚砂的成分是SiC,其熔沸点很高,硬度大,可作砂纸、砂轮的磨料,故选A.
答案:A
8.下列离子方程式书写不正确的是
( )
A.SiO2与烧碱溶液作用:SiO2+2OH-===SiO+H2O
B.向烧碱溶液中通入足量CO2:CO2+OH-===HCO
C.晶体硅与烧碱溶液作用:
Si+2OH-+H2O===SiO+2H2↑
D.CaCO3溶于稀硝酸中:CO+2H+===CO2↑+H2O
解析:SiO2与CO2均具有酸性氧化物的性质,均能与碱作用生成盐和水,但CO2过量时生成碳酸氢盐,故A、B正确;C项中单质硅能与NaOH作用生成Na2SiO3同时放出H2,正确;D项中CaCO3难溶于水,应写化学式,D错误.
答案:D
7.下列物质中,按其成分能与玻璃、水泥、陶瓷归于同一类的是
( )
A.硅石 B.碳化硅
C.硅酸钠 D.二氧化硅
解析:玻璃、水泥、陶瓷的成分中均含硅酸盐,因此选C.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com