
题目列表(包括答案和解析)
3.(2010·唐山模拟)下列各组物质依次表示为a、b、c、d,图中箭头表示一步转化.满足如图所示转化关系的是( )
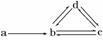
A.Na Na2O2 NaOH Na2CO3
B.S SO2 H2SO3 NaHSO3
C.Cu CuO Cu(OH)2 CuSO4
D.Si SiO2 H2SiO3 Na2SiO3
解析:选项A中NaOH、Na2CO3不能一步转化为Na2O2;选项C中CuO不能一步转化为Cu(OH) 2,CuSO4不能直接转化为CuO;选项D中SiO2不能直接转化为硅酸,硅酸钠也不能直接转化为二氧化硅.
2,CuSO4不能直接转化为CuO;选项D中SiO2不能直接转化为硅酸,硅酸钠也不能直接转化为二氧化硅.
答案:B
2.(2010·潍坊模拟)以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂以除去氧气,以下可作为缓蚀剂的是( )
A.KM nO4
B.NaNO2
nO4
B.NaNO2
C.FeCl3 D.HNO3
解析:Na NO2具有还原性,能被O2氧化成NaNO3,故可以用NaNO2除去O2.
NO2具有还原性,能被O2氧化成NaNO3,故可以用NaNO2除去O2.
答案:B

[基础等级评价]
1.(2010·福建高考)下表各组物质中,满足下图物质一步转化关系的选项是( )
|
选项 |
X |
Y |
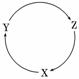 Z Z |
|
A |
Na |
NaOH |
NaHCO3 |
|
B |
Cu |
CuSO4 |
Cu(OH)2 |
|
C |
C |
CO |
CO2 |
|
D |
Si |
SiO2 |
H2SiO3 |
解析:本题考查元素化合物,意在考查考生对常见金属和非金属元素及其化合物相互转化的理解和分析能力.NaHCO3不能一步转化为Na,A项错误;Cu(OH)2不能一步转化为Cu,B项错误;根据CCOCO2C知,C项正确;H2SiO3不能一步转化为Si,D项错误.
答案:C
27.在溶液中,反映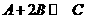 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为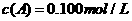 、
、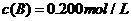 及
及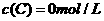 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。
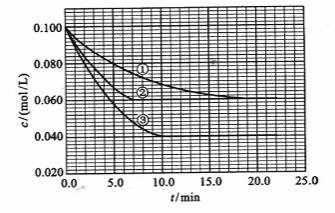
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;
③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的 _________0,判断其理由是____
_________0,判断其理由是____ ______________________________;
______________________________;
(4)该 反应进行到4.0min时的平均反应速度率:
反应进行到4.0min时的平均反应速度率:
实验②: =__________________________________;
=__________________________________;
实验③: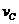 =__________________________________。
=__________________________________。
关于2011年高考化学计算部分的一点思考
从近三年的高考试题可以看出,化学计算可依赖于各种题型表现出来,而考纲中要求学生掌握的各个知识点,在化学计算中都有可能考察到。从《考试说明》分析,化学计算主要分成两类,一类是有关物质的量、物质的量浓度、气体摩尔体积、阿伏加德罗常数、pH、反应热、化学反应速率、反应物转化率等基本概念的计算;另一类是根据常见元素的单质及其重要化合物的性质,以化学方程式为载体的综合计算。结合高考改革与命题的特点,我认为未来的高考中,化学计算部分可能具有以下几个特点:
(1) 传统题型可能会出现。如阿伏加德罗常数与粒子数之间的关系,离子浓度的计算,反应热的计算,有机物分子式的确定等等。说到阿伏加德罗常数与粒子数之间的关系,很有趣的是,最近连续三年都没有考到,不论今年会不会重现,此类的知识点我们必须讲得透彻到位。
(2) 对实验的考察不仅定性,可能还会定量,推断题逐步从定性推断转变为计算与性质推断相结合,因而在实验题和推断题中也将会涉及到化学计算。
(3) 可能会出现以氧化还原、化学平衡、电化学为载体的化工生产,将化学反 应、转化率、产率等与物质的量或浓度融合在一起进行考察。
记得去年我带复读的时候,同组的樊老师在考前说,2009年综合大题中考到电解,那2010年可能会有一个大题是关于化学平衡的,结果果然如他所说。这是一个经验老到的教师对高考的敏感。我们不可能猜到具体的题目,但是考察的大致方向我们往往可以捕捉得到。
应对策略
(1)熟读考纲和考试说明。会考什么,不会考什么,哪些应该 掌握透彻,哪些只需大致了解,作为老师,我们应该对此非常熟悉
掌握透彻,哪些只需大致了解,作为老师,我们应该对此非常熟悉 。对教学大纲和考纲以外的知识和技能,绝对不讲,不浪费学生复习时间,增加学生不必要的负担,如平衡常数、电离常数、电离度等有关计算。对于高考热点,反而要不惜时间、精力,全方位不间断地加以训练。如关于物质的量浓度的计算,不仅要讲计算,而且要和“一定物质的量浓度溶液的配制实验”结合起来,让学生亲身体会化学计算与实验、实际的联系;而且要和气体溶质如NH3的溶解、初中所学知识点物质的溶解度等知识结合起来,消除学生思维的盲点,拓展学生的思维,训练学生计算的基本技能。
。对教学大纲和考纲以外的知识和技能,绝对不讲,不浪费学生复习时间,增加学生不必要的负担,如平衡常数、电离常数、电离度等有关计算。对于高考热点,反而要不惜时间、精力,全方位不间断地加以训练。如关于物质的量浓度的计算,不仅要讲计算,而且要和“一定物质的量浓度溶液的配制实验”结合起来,让学生亲身体会化学计算与实验、实际的联系;而且要和气体溶质如NH3的溶解、初中所学知识点物质的溶解度等知识结合起来,消除学生思维的盲点,拓展学生的思维,训练学生计算的基本技能。
(2)不单纯为化学计算专题复习而复习,而把化学计算基本类型和方法规律的复习分解渗透于其它各块知识的复习中,只有掌握化学的本质,吃透各块知识点,才可以快速准确地进行计算,得到结果。纵观近几年的高考题,以往的那种纯计算的大题已很少出现,而通常是把计算与基本概念、基本理论、元素化合物、有机化学、化工生产联系(江苏高考尤其如此)在一起。这就要求我们在平时的复习中下功夫,要把化学计算的各种基本类型分解渗透到各块知识的复习中,这样,学生既有良好的知识技能储备,又能对学生知识技能的复习更加生活系统化、条理化,进而提高复习的效率。
(3)教给学生计算的方法和技巧。结合化学学科实际,计算时通常用到如下方法:
守恒法、关系式法、差量法、极值假设法、讨论法、数形结合法
下面我就守恒法和关系式法略作论述。
守恒法: 守恒法就是巧妙地选择化学式中某两数(如正负化合价总数、正负电荷总数)始终保持相等,或几个连续的化学方程式前后某粒子(如原子、电子、离子)的物质的量保持不变,作为解题的依据,这样可避免书写繁琐的化学 方程式,从而加快解题的速度,提高解题的准确性。
方程式,从而加快解题的速度,提高解题的准确性。
化学中有多种守恒关系,如元素守恒、电荷守恒、得失电子守恒等,在化学计算中,我们通常可以用它们来解决如下几种情况:
a. 根据反应前后某一微粒的物质的量不变进行巧解。
b. 根据化合物中正负化合价总数相等确立化学式。
c. 根据化学式中阴阳离子所带电荷总数相等,求离子所带的电荷或某离子的物质的量或物质的量浓度,如2009的第7题。
d. 根据氧化还原中氧化剂得到的电子数等于还原剂失去的电子数进行的相关计算。
e. 根据原电池或电解池中两极得失电子数相等,求两极产物的物质的量或未知金属的相对原子质量。
例一: 14克铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12升(标准状况)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
A. 9.6克 B. 6.4克
C. 3.2克 D. 1.6克
解答:硝酸的浓度不知,气体是纯的NO还是NO2,还是它们组成的混合物,若是混合气体,NO和NO2的体积比多大,这些我们都不清楚。这样一来,解题条件好象不足。但是我们可以换个角度思考问题。合金失去电子给硝酸,硝酸得到电子之后生成NO或NO2或两者的混合物。此后,气体又将电子转给氧气,全部变回到硝酸。这样一来,可认为电子转移直接发生在合金和氧气之间,而硝酸只是过了一下手而已。1mol铜失2mol电子,1mol银失1mol电子,1mol氧气得4mol电子。设合金中铜有Xmol,银有Ymol,
① 64X+108Y=14 ②2X+Y=0.05 联立解得铜有3.2克,答案为C,在解题时就用到了得失电子守恒。
例二:向一定质量的Fe3O4、Fe、FeO的混合物中加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液不变色。若用足量CO在高温下还原相同质量的混合物,得到铁的质量是( )
A 11.2g B 5.6g C 2.8g D 无法计算
解答:加入KSCN溶液不变红色,说明溶液中无Fe3+,溶质全为FeCl2,Fe的物质的量为盐酸的物质的量的一半,为0.05 mol,这些Fe就是来自原来的混合物,等质量的混合物被CO还原后得到Fe的质量当然也是0.05 mol,2.8g,答案为C。
守恒法的应用在化学计算中非常广泛,应该说,它不仅仅是一种方法,一种技巧,而是一种思想境地,一种智慧。
关系式法:在多步反应的计算中,可以把始态的反应物和终态的生成物之间的物质的量的关系表示出来,把多步计算简化成一个简单的物质的量关系,列式解答。
例三:某硫酸厂每天用含FeS260﹪的`黄铁矿500吨生产硫酸,如果在沸腾炉内损失5﹪的硫,SO2的转化率为90﹪,该硫酸厂每天能生产98﹪的硫酸多少吨?
解析:这道题中涉及到的反应比较多,但是我们根据S原子的个数守恒,找到FeS2和H2SO4之间的理论计量数关系为FeS2-2 H2SO4 ,求得结果。不过说到底,我们还是利用了原子守恒的思想方法,也可直接根据S守恒列计算式
500×60﹪×(64/120)×95﹪×90﹪= Y×98﹪×(32/9
Y×98﹪×(32/9 8)(设Y为所求)
8)(设Y为所求)
这样解得所求为427.5吨。
(4)对学生进行解题指导
a.仔细审题,抓住关键词,减少失误。
b.答题一定要推理严实,规范有序,文字表达准确无误。
c.养成带单位计算的习惯。
d.过量问题的计算必须先判断后计算。
e.  关键的“设”、“答”不能少。
关键的“设”、“答”不能少。
f. 有效数字的取用要注意。
g.多总结试题特点,归纳提炼解题思想,掌握解题方法技巧,开阔视野,增强对计算题的应变能力。
h.面对理综,冷静沉着。
(5)对学生进行心理辅导
在平时的理综训练时,我经常发现学生将计 算题空着不做,就问为什么,学生说,一看到计算题,头都大了,先放着,等会有时间再说。的确,理综考试,题目多,分值大,时间短,许多学生遇到计算干脆暂时放弃。但这种做法是不可取的,但再入题目的意境是要耗时的,而计算题的分值通常比较大,放弃了的确可惜,所以得尽力就时就地解决。我们要鼓励学生,
算题空着不做,就问为什么,学生说,一看到计算题,头都大了,先放着,等会有时间再说。的确,理综考试,题目多,分值大,时间短,许多学生遇到计算干脆暂时放弃。但这种做法是不可取的,但再入题目的意境是要耗时的,而计算题的分值通常比较大,放弃了的确可惜,所以得尽力就时就地解决。我们要鼓励学生,
高考中计算题一般不会很繁杂难算,在经过了那么多的有效训练之后,我们很有信心解决这些貌似难缠的计算题。
12.一定条件下磷与干燥氯气反应,若0.25g磷消耗掉314mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于
A.1:2 B.2:3 C.3:1 D.5:3
9.下列叙述正确的是
A.在醋酸溶液的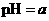 ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的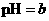 ,则
,则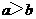
B.在滴有酚酞溶液的氨水里,加入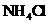 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的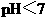
C.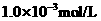 盐酸的
盐酸的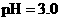 ,
,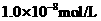 盐酸的
盐酸的
D.若1mL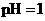 的盐酸与100mL
的盐酸与100mL 溶液混合后,溶液的
溶液混合后,溶液的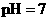 则
则 溶液的
溶液的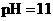
28.下图所示装置 中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
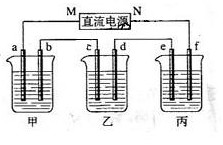
(1) 接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液
 ;
;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
相对于2008年,2009年的试题中涉及到化学计算的题量增多,分值增大,考察的知识点也更多,如第7题物质电荷守恒,第9题有机物分子式的处理技巧,第11题依据化学方程式进行计算,第13题转化率的计算,第28题电 解的有关计算,在第30题(有机推断题)中物质A的分子式的确定时,也用到了简单的化学计算。
解的有关计算,在第30题(有机推断题)中物质A的分子式的确定时,也用到了简单的化学计算。
2010年理科综合化学部分涉及到计算的题有:
11.为了检验某含有 杂质的
杂质的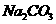 样品的纯度,现将
样品的纯度,现将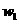 克样品加热,其质量变为
克样品加热,其质量变为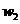 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是
A.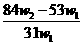 B.
B.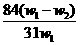 C.
C.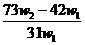 D.
D.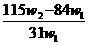
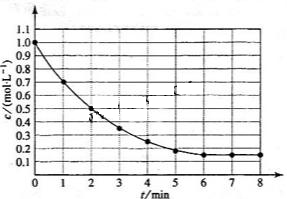 13.下图表示反应
13.下图表示反应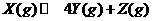 ,
,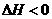 ,在某温度时
,在某温度时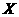 的浓度随时间变化的曲线:
的浓度随时间变化的曲线:
下列有关该反应的描述正确的是
A.第6 后,反应就终止了
后,反应就终止了
B.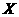 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度,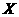 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减少
9.现有乙酸和两种链状单烯烃混合物,其中氧的质量分数为a,则碳的质量分数是
A.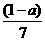 B.
B.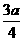 C.
C.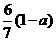 D.
D.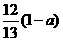
7.将15ml.2mol•.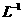
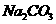 溶液逐滴加入到40 ml.0.5mol•.
溶液逐滴加入到40 ml.0.5mol•.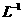
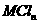 盐溶液中,恰好将溶液中的
盐溶液中,恰好将溶液中的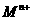 离子完全沉淀为碳酸盐,则
离子完全沉淀为碳酸盐,则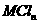 中n值是
中n值是
A. 4 B. 3 C. 2 D. 1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com