
题目列表(包括答案和解析)
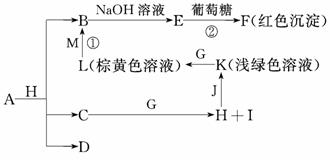
5.各物质之间的转化关系如下图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
请回答下列问题:
(1)写出A的化学式____________________,C的电子式________________________.
(2)比较Y与Z的原子半径大小______>________(填写元素符号).
(3)写出反应②的化学方程式(有机物用结构简式表示)_________________________,举出该反应的一个应用实例_______________________________________________________.
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体.请写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________.
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称______________、____________、______________.
解析:黄绿色气体单质G为Cl2;由框图中K(浅绿色溶液)L(棕黄色溶液)+单质金属M①B,且反应①常用于制作印刷线路板,则该转化关系为:FeCl2FeCl3CuCl2.化合物C与Cl2反应生成H和I,其中I有漂白作用,故C为H2O、H为HCl、I为HClO.元素X、Y、Z原子序数依次增大,其中X的原子半径最小,为氢元素,三元素中两种组成的化合物C是水,故另一元素为氧元素,由Y、Z原子最外层电子数之和为10说明Y元素为碳元素,D为无色非可燃性气体,且由H、C、O三元素中的两种组成,则D为CO2.A与H(HCl)反应生成CuCl2、H2O和CO2,A的分子组成可能为CuCO3或碱式碳酸铜[Cu2(OH)2CO3].
答案:(1)Cu2(OH)2CO3[Cu(OH)2·CuCO3]或CuCO3
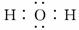
(2)C O
(3)CH2OH(CHOH)4CHO+2Cu(OH)2
CH2OH(CHOH)4COOH+Cu2O↓+2H2O 医学上可用此反应检验尿液中的葡萄糖
(4)3Cu2O+14HNO3(稀)===6Cu(NO3)2+2NO↑+7H2O
(5)金刚石 石墨 富勒烯(C60)或碳纳米管等
4.(2010·海南高考)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
(1)A与水反应的化学方程式为________________________________,E与水反应的化 学方程式为________________________________;
学方程式为________________________________;
(2)F的化学式为________,G和D的电子式分别为________________和________________;
(3)D与H反应可能生成的盐有__________________(填化学式);
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法______________________.
解析:由题干信息可推知,A是钙,F是CaCO3,其他易推出,B是H2,C是Ca(OH)2,E是NaH,D是CO2,G是CaO,H是NaOH,(3)小题CO2和NaOH溶液可能发生反应有:CO2+2NaOH===Na2CO3+H2O,CO2+H2O+Na2CO3===2NaHCO3.
 答案:(1)Ca+2H2O===Ca(OH)2+H2↑ NaH+H2O===NaOH+H2↑
答案:(1)Ca+2H2O===Ca(OH)2+H2↑ NaH+H2O===NaOH+H2↑
(2)CaCO3
(3)Na2CO3、NaHCO3
(4)CaCO3高温加热分解生成CaO,CaO经电解生成单质Ca
3.1 mol过氧化钠与2 mol碳酸氢钠固体混合物,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
解析:由反应①2NaHCO3Na2CO3+CO2↑+H2O
②2Na2O2+2CO2===2Na2CO3+O2
③2Na2O2+2H2O===4NaOH+O2↑
2 mol NaHCO3分解生成1 mol CO2和1 mol H2O,若1 mol H2O与1 mol Na2O2反应,则生成2 mol NaOH,2 mol NaOH又恰好与1 mol CO2完全反应生成Na2CO3,若1 mol CO2直接与1 mol Na2O2反应,也生成Na2CO3.
答案:A
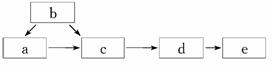
2.如图为含有同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是①C ②N2 ③S ④F2中的( )
A.只有①和③ B.只有④
C.①②③ D.①②③④
解析:此题用代入法,根据选项答案的特点,首先将④中的F2代入,则c、d不可能为F的氧化物,且F元素不存在最高价氧化物对应的水化物,故B、D不正确;然后将②代入,a为N2,b为NH3,c为NO,d为NO2,e为HNO3,则C正确.
答案:C
14.(12分)E为黑色物质,A是一种蓝色溶液,B是气体单质,C是一种金属单质.
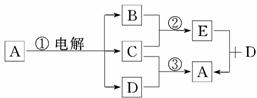
(1)A是________,D是________,写出反应①的离子方程式______________________
__________________________________________________.
(2)在反应③中,产生气体的体积为2.24 L(标准状况),被还原的D的物质的量为________,若此时溶解C的质量为6.4 g,试确定气体的成分及物质的量_________________.
(3)若图中C与D的稀溶液不反应,则A是________.
解析:A为蓝色溶液,溶液中含有Cu2+,电解含Cu2+的溶液时能得到金属单质C和 气体单质B,则C为Cu,E为含铜元素的黑色物质,故B为O2,E为CuO.
气体单质B,则C为Cu,E为含铜元素的黑色物质,故B为O2,E为CuO.
由反应③可知,D为能与Cu反应的酸,故D为HNO3,A为Cu(NO3)2.
n(Cu)==0.1 mol
设生成NO x mol,NO2 y mol
则
解得x=0.05 mol,y=0.05 mol.
答案:(1)Cu(NO3)2溶液 HNO3 2Cu2++2H2O电解2Cu+O2↑+4H+
( 2)0.1 mol NO:0.05
mol,NO2:0.05 mol
2)0.1 mol NO:0.05
mol,NO2:0.05 mol
(3)CuSO4溶液

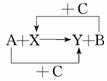 1.已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).
1.已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).
下列A、B间的对应关系,不正确的是( )
A.A是铝,B是铁 B.A是碳,B是硅
C.A是氢气,B是铜 D.A是钠,B是氢气
解析:由题意知,C是氧气,则X、Y均为氧化物.A项中恰好是铝和铁的氧化物发生铝热反应, B项是碳还原SiO2,C项是H2还原CuO,D项钠与氧气反应不能得到NaOH.
B项是碳还原SiO2,C项是H2还原CuO,D项钠与氧气反应不能得到NaOH.
答案:D
13.(10分)(2010·郑州模拟)如图为一些常见无机物之间的转化关系,其中常温下E是一种无色无味的液体,F是一种淡黄色粉末,G是一种无色无味的气体.请回答下列问题:
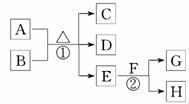
(1)F的电子式为__________________;在反应②中,每生成2.24 L(标准状况下)气体G,反应转移电子的数目为________ NA(NA代表阿伏加德罗常数的值).
(2)若A与B均为固体化合物,C是一种常见的中性干燥剂,写出反应①的化学方程式:________________________________________________________________________.
(3)若C、D均为气体,且都能使澄清石灰水变浑浊,B、C、D、E中含有同种元素,则A与B分别为__________、______________(写名称).
解析:(1)无色无味的液体E为H2O,F为淡黄色固体且能与水反应产生无色无味的气体,则F为Na2O2,G为O2,H为NaOH.
(2)若A、B均为固态化合物,C是一种常见的中性干燥剂,则C为CaCl2,反应①为NH4Cl和Ca(O H)2混合共热制取NH3的反应.
H)2混合共热制取NH3的反应.
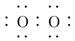 (3)若C、D是均能使澄清石灰水变浑浊的气体,则C、D为SO2和CO2.将A、B共热可生成CO2、SO2和H2O.则反应①为C与浓H2SO4的反应.
(3)若C、D是均能使澄清石灰水变浑浊的气体,则C、D为SO2和CO2.将A、B共热可生成CO2、SO2和H2O.则反应①为C与浓H2SO4的反应.
答案:(1)Na+[ ]2-Na+ 0.2
(2)2NH4Cl+Ca(OH)2△CaCl2+2NH3↑+2H2O
(3)碳 浓硫酸
12.(18分)(2010·浙江高考)汽车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验.经组成分析,确定该粉末仅含Na、Fe、N、O四种元素.水溶性实验表明,固体粉末部分溶解.经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸.
取13.0 g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72 L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质.化合物丙与空气接触可转化为可溶性盐.
请回答下列问题:
(1)甲的化学式为____________,丙的电子式为____________.
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为_________________________
_______________________________________________.
(3)单质乙与红棕色粉末发生反应的化学方程式为___________________________,安全气囊中红棕色粉末的作用是______________________________________________________.
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是________.
A.KCl B.KNO3
C.Na2S D.CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物)________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________.
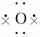 解析:本题主要考查元素的推断及元素化合物等知识,意在考查考生的逻辑思维能力和对知识的迁移拓展能力.红棕色固体为Fe2O3,则可溶物中含有Na、N元素,再由化合物甲受热分解生成氮气和单质乙,知乙为单质钠,甲中含有钠元素和氮元素,由题给信息计算知甲的化学式为NaN3.钠在高温隔绝空气条件下与Fe2O3发生置换反应,生成铁和Na2O,故丙为Na2O,Na2O与空气中的CO2和H2O反应生成Na2CO3或NaHCO3.若Na2O转化为NaHCO3,则反应的方程式为:Na2O+2CO2+H2O===2NaHCO3.
解析:本题主要考查元素的推断及元素化合物等知识,意在考查考生的逻辑思维能力和对知识的迁移拓展能力.红棕色固体为Fe2O3,则可溶物中含有Na、N元素,再由化合物甲受热分解生成氮气和单质乙,知乙为单质钠,甲中含有钠元素和氮元素,由题给信息计算知甲的化学式为NaN3.钠在高温隔绝空气条件下与Fe2O3发生置换反应,生成铁和Na2O,故丙为Na2O,Na2O与空气中的CO2和H2O反应生成Na2CO3或NaHCO3.若Na2O转化为NaHCO3,则反应的方程式为:Na2O+2CO2+H2O===2NaHCO3.
答案:(1)NaN3 Na+[ ]2-Na+
(2)Na2O+2CO2+H2O===2NaHCO3
(3)6Na+Fe2O32Fe+3Na2O 避免分解产生的金属钠可能产生的危害
( 4)B、D (5)可溶性盐的成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3的混合物.准确称取一定量的生成物,加热至恒重后,如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3,或Na2CO3与NaHCO3的混合物.
4)B、D (5)可溶性盐的成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3的混合物.准确称取一定量的生成物,加热至恒重后,如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3,或Na2CO3与NaHCO3的混合物.
11.(10分)(2010·东城模拟)A、B、C、D、E均为中学化学中的常见单质或化合物,它们之间的反应关系如图所示:

(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是________________________________________;工业上冶炼A的化学反应方程式是______________________________________________.
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是__________________________________;1 mol C完全燃烧生成液态水时放出1 300 kJ的热量,则C完全燃烧的热化学方程式是________________________________________.A与B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是____________________
____________________________________________________.
解析:(1)根据“若A是短周期中原子半径最大的元素构成的单质”可知A为Na,根据“E既可溶于盐酸又可溶于NaOH溶液”可知E为Al(OH)3,B溶液为含有Al3+的盐溶液,气体C为H2,D为钠盐.工业上通过电解熔融NaCl来冶炼金属钠.
(2)根据“C是既含有极性键又含有非极性键的四原子分子”可推知C为C2H2,固体A为CaC2,CaC2与H2O反应生成C2H2:CaC2+2H2O―→C2H2↑+Ca(OH)2.根据热化学方程式的书写原则,可写出C2H2完全燃烧的热化学方程式.CaC2与Ca(HCO3)2溶液反应生成C2H2、CaCO3和H2O.
答案:(1)Al(OH)3+OH-===AlO+2H2O
2NaCl(熔融)电解2Na+Cl2↑
(2)CaC2+2H2O―→C2H2↑+Ca(OH)2
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l);ΔH=-2 600 kJ·mol-1 Ca(HCO3)2
10.(2010·郑州模拟)X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图所示的转化关系,下列有关说法错误的是  ( )
( )
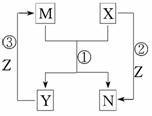
A.该过程所涉及的反应均为氧化还原反应
B.当X单质为金属时,可能是Na或Fe
C.当X单质为非金属时,可能是F2或C
D.反应①可能在常温下进行,也可能需要在高温下才能发生
解析:当X为Fe时,N为Fe3O4,而Fe3O4可由Fe与O2反应得到,O2与H2反应也可以转变为H2O;若X为Na,Na与水反应生成的是NaOH,而Na与O2反应生成的则是Na2O2或Na2O,所以,B项错误.
答案:B
9.由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去).
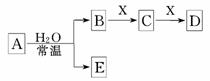
下列推断不正确的是( )
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
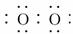 B.若A是单质,B和D的反应是OH-+HCO===H2O+CO,则E一定能还原Fe2O3
B.若A是单质,B和D的反应是OH-+HCO===H2O+CO,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式为Na+[ ]2-Na+
D.若D为白色沉淀,与A的摩尔质量相等,则X一定是铝盐
解析:本题采用代入验证法处理各选项中的内容,若X是Na2CO3,C为含极性键的非极性分子CO2.A可能是Cl2或F2,选项A错误.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com