
题目列表(包括答案和解析)
4.下列各组物质相互混合后,最终既有气体生成又有沉淀生成的是( )
①Al投入NaOH溶液 ②Na投入CuSO4溶液
③Ba(OH)2溶液和(NH4)2CO3溶液共热
④过量Na2O2加入AlCl3溶液 ⑤镁投入NH4Cl溶液
A.①②③ B.②③
C.②④⑤ D.④⑤
解析:反应①只有H2生成没有沉淀生成;反应②有H2和Cu(OH)2沉淀生成;反应③有NH3和BaCO3沉淀生成;反应④有O2生成,但最终没有沉淀生成;反应⑤只有气体(H2和NH3)生成.
答案:B
3.某化学兴趣小组,设计了验证Fe、Cu、Ag的金属活动性顺序的多种方案,每种方案所需的试剂如下:
①Fe、CuSO4溶液、Ag ②FeCl2溶液、Cu、AgNO3溶液 ③Fe、Cu、稀盐酸、AgNO3溶液 ④FeSO4溶液、Cu、Ag
你认为可行的方案是( )
A.①②③ B.②④
C.③④ D.①②④
解析:①Fe能置换出CuSO4溶液中的Cu,Ag却不和CuSO4溶液反应,故有活动性:Fe>Cu>Ag;②Cu能与AgNO3溶液反应置换出Ag,而Cu不能与FeCl2溶液反应,故有活动性:Fe>Cu>Ag;③Fe能和稀盐酸反应,而Cu不能和稀盐酸反应,Fe和Cu都能和AgNO3溶液反应,故有活动性:Fe>Cu>Ag;④Cu和Ag都不与FeSO4溶液反应,不能判断Cu和Ag的活动性顺序.
答案:A
2.下列金属冶炼的反应原理,错误的是( )
A.MgCl2(熔融)Mg+Cl2↑
B.Al2O3+3H22Al+3H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
解析:金属冶炼的方法很多,由于金属离子得电子的能力不同,因此必须采取不同的冶炼方法.在金属活动性顺序表中,位于氢后面的金属(Hg、Ag等)的氧化物受热就能分解;位于前面的几种金属(如K、Na、Ca、Al等)的还原性太强,这些金属都很容易失去电子,只能用电解其熔融盐或氧化物的方法来冶炼.
答案:B
1.相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
解析:根据Al、Al(OH)3、AlCl3、Al2O3与NaOH溶液反应的方程式可知,等质量的上述四种物质与NaOH反应时,消耗NaOH量最多的为Al.
答案:A
5.(2010·南昌模拟)为探究物质的性质,某研究性学习小组进行如下实验:
将a g铜投入250 mL某浓度的Fe2(SO4)3溶液中,铜完全溶解得溶液X,再向溶液X中加入b g铁粉充分反应后得溶液Y及残留固体c g,且测得a>c.
请回答:
(1)比较a、c大小的仪器(填名称):______________.
(2)从实验数据分析残留固体一定是________.
(3)写出溶液X中加入铁粉发生反应的离子方程式:
①________________________________________________________________________;
②________________________________________________________________________.
解析:(1)比较铜与残留固体质量的仪器是托盘天平(砝码);(2)根据题意,可知溶液X为CuSO4、FeSO4和Fe2(SO4)3的混合溶液,溶液Y为FeSO4.整个过程发生的反应有:Cu+Fe2(SO4)3===CuSO4+2FeSO4,Fe+Fe2(SO4)3===3FeSO4,Fe+CuSO4===FeSO4+Cu.由于a>c,故残留固体一定为铜.
答案:(1)托盘天平(砝码)
(2)Cu
(3)2Fe3++Fe===3Fe2+
Fe+Cu2+===Fe2++Cu
[发展等级评价]
(限时45分钟,满分100分)
4.(2010·郑州模拟)将一定量铁粉和铜粉的混合物加入由稀H2SO4和稀HNO3组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )
A.反应过程中不可能产生H2
B.剩余的金属粉末中一定有铜
C.往反应后的溶液中加入KSCN溶液会变血红色
D.往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少
解析:由金属单质的还原性强弱可知,首先参加反应的一定是活泼性强的铁,当铁反应完后,若溶液中还有H+与NO或Fe3+,这时才会有单质铜的溶解,所以,反应后的剩余金属有两种可能,一是铁与铜的混合物,二是只有铜一种单质.而当有未反应的金属存在时,则溶液中就不可能存在H+与NO或Fe3+.
答案:B
3.(2010·长春模拟)在四种化合物①NaHCO3、②Al(OH)3、③Al2O3、④H2N-CH2-COOH中,跟盐酸和氢氧化钠溶液都能反应的是( )
A.只有②④ B.只有①②
C.只有①②③ D.①②③④
解析:NaHCO3跟盐酸和氢氧化钠溶液都能反应:NaHCO3+NaOH===Na2CO3+H2O,NaHCO3+HCl===NaCl+H2O+CO2↑.Al(OH)3为两性氢氧化物,Al2O3为两性氧化物,H2N-CH2-COOH为甘氨酸,三者均既能与盐酸反应,又能与氢氧化钠溶液反应.
答案:D
2.(2010·潍坊模拟)取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是 ( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质
A.②⑤ B.①②③
C.①④⑤ D.④⑤
解析:钠在空气中燃烧生成淡黄色的Na2O2,其焰色反应为黄色.
答案:C

[基础等级评价]
1.(2010·重庆高考)下列叙述正确的是( )
A.铝制容器可盛装热的浓H2SO4
B.AgI 胶体在电场中自由运动
C.K与水反应比Li与水反应剧烈
D.红磷在过量Cl2中燃烧生成PCl3
解析:热的浓硫酸与铝反应,A错;AgI胶体在电场中定向移动 ,存在电泳现象,B错;K的金属性比Li强,更易与水反应,C正确;红磷在过量氯气中燃烧生成PCl5,D错.
答案:C
6.(2010·新课标全国卷,有改动)物质A-G有下图所示转化关系(部分反应物、生成物没有列出).其中A为某金属矿的主要成分,经过一系列反应可得到B和C.单质C可与E的浓溶液发生反应,G为砖红色沉淀.
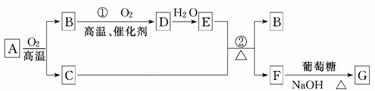
请回答下列问题:
(1)写出下列物质的化学式:B________、E__________、G________;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是________;
(3)反应②的化学方程式是__________________________________________________.
解析:(1)由连续氧化:AO2BO2DH2OE及反应①的条件,得B为SO2,D为SO3,E为硫酸.F与葡萄糖、NaOH加热反应生成砖 红色沉淀G,则G为Cu2O,单质C为铜.(2)铜的精炼,以粗铜作阳极,精铜作阴极,以含Cu2+的电解质溶液作电解液.
红色沉淀G,则G为Cu2O,单质C为铜.(2)铜的精炼,以粗铜作阳极,精铜作阴极,以含Cu2+的电解质溶液作电解液.
答案:(1)SO2 H2SO4 Cu2O
(2)粗铜 精铜 CuSO4溶液
(3)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com