
题目列表(包括答案和解析)
4.X、Y、Z、W、R是周期表前20号元素,它们的原子序数依次增大,X与R,Y与W分别同主族,Z原子最外层电子数是W原子最外层电子数的一半,X与Y可形成X2Y和X2Y2两种液态化合物.下列说法不正确的是( )
A.原子半径:R>Z>W>Y>X
B.离子半径:X、Z、Y、W、R依次增大
C.热稳定性:X2Y>X2W
D.由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂
解析:根据题中信息可知,X、Y、Z、W、R分别代表的元素是氢、氧、铝、硫、钾.B项离子半径应该是按X、Z、Y、R、W的顺序依次增大.由X、Y、Z、W、R五种元素组成的化合物明矾可作净水剂.
答案:B
3.将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
①用物质A表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为 0.6 mol·L-1·s-1
③2 s 时物质 A 的转化率为70%
④2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是( )
A.①③ B.①④
C.②③ D.③④
解析:v(C)=0.6 mol/L÷2 s=0.3 mol·L-1·s-1
v(A)=0.3 mol·L-1·s-1
v(B)=0.15 mol·L-1·s-1
A的转换率为0.6 mol/L×2 L÷4 mol×100%=30%.2 s时B的浓度为1 mol/L-v(B)×2 s=0.7 mol/L.只有①、④正确.
答案:B
2.下表是元素周期表的一部分,有关说法正确的是( )
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
2 |
|
|
|
a |
b |
c |
|
|
3 |
d |
e |
f |
g |
|
h |
i |
A.a、b、e、f四种元素的原子半径:e>f >b>a
B.h、i两种元素阴离子的还原性:h>i
C.a、g两种元素氢化物的稳定性:g>a
D.d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强
解析:a、b、c、d、e、f、g、h、i代表的元素分别是C、N、O、Na、Mg、Al、Si、S、Cl.由此可以判断a、b、e、f四种元素的原子半径:e>f>a>b;a、g两种元素氢化物的稳定性:甲烷>硅烷;d、e、f三种元素最高价氧化物对应的水化物的碱性依次减弱.所以A、C、D错误.
答案:B
1.2009年俄罗斯和美国同时宣布,成功合成了113号和115号新元素,已知115号元素的一种同位素X,下列有关113号、115号元素的叙述正确的是( )
A.113号元素位于周期表第八周期
B.115号元素的该种同位素,中子数与电子数之差为174
C.该115号元素原子与碳-12原子质量之比为115∶12
D.115号元素可显+5价
解析:根据元素周期表的排布规律,第七周期排满,最后一种元素的原子序数是118,A错.该115号元素的这种核素中,中子数与电子数之差为59, B 错.该115号元素原子与碳-12原子质量之比为289∶12,C错.
答案:D
5.00×10-3 mol n n
所以n=6×5.00×10-3 mol=3.00×10-2 mol;
由原子守恒可得:
Cr0.5Fe1.5FeO4-1.5Fe3+-FeO(其中后为+2价)
n′ 3.00×10-2 mol n′
所以n′=2.00×10-2 mol.
所以n(Fe)=(3.00×10-2+2.00×10-2)mol=5.00×10-2 mol
m(FeSO4·7H2O)=5.00×10-2 mol×278 g·mol-1=13.9 g.
答案:(1)Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O
(2)将一小片pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照
(3)Fe(OH)3、Fe(OH)2 (4)13.9
5.某厂废水中含5.00×10-3 mol·L-1的Cr2O,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
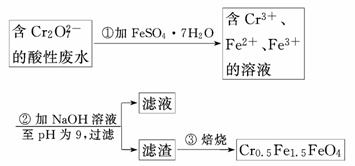
(1)第①步反应的离子方程式是______________________________________________
________________________________________________________________________.
(2)第②步中用pH试纸测定溶液pH的操作是:________________________________
________________________________________________________________________.
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有________.
(4)欲使1 L该废水中的Cr2O完全转化为Cr0.5Fe1.5FeO4,理论上需要加入__________g FeSO4·7H2O.
解析:(1)Cr2O有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应Cr2O转化为Cr3+,Fe2+转化为Fe3+.
Cr2O+14H++6Fe2+===2Cr3++6Fe3++7H2O.
(2)广泛pH试纸是中学化学常用物品,使用时不得先润湿.应将试纸展放在表面皿上,用玻璃棒蘸取待测液滴在试纸中部,再与标准比色卡对照得出pH.
(3)由题给框图之二可得:Fe2+过量,加NaOH时,产生
Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀.
(4)1 L废水中含n(Cr2O)=5.00×10-3 mol.
Cr2O+14H++6Fe2+===2Cr3++6Fe3++7H2O
1 6 6
4.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2 mol·L-1H2SO4溶液
B.18 mol·L-1H2SO4溶液
C.6 mol·L-1KOH溶液
D.3 mol·L-1HNO3溶液
解析:此题首先排除B、D两个选项,因为18 mol·L-1H2SO4溶液是浓硫酸,它与镁铝合金作用不产生氢气.3 mol·L-1 HNO3溶液与镁铝合金作用也不产生氢气.A选项中,镁、铝均可以完全反应产生氢气,而C选项中,镁不与KOH溶液反应,故产生氢气最多的是2 mol·L-1 H2SO4溶液.
答案:A
3.将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜.再经充分反应后,溶液中一定含有的金属离子是( )
A.Fe3+和Cu2+ B.Fe2+和Cu2+
C.Fe2+ D.Fe2+和Fe3+
解析:Fe和Cu都能与Fe3+反应,Fe能与Cu2+反应,所以溶液中一定不含Fe3+和Cu2+.
答案:C
2.(2010·赣州模拟)下列各组中两种浓溶液相混合时既无沉淀析出又无气体放出的是 ( )
A.Ba(HCO3)2、NaHSO4
B.NaHCO3、Al2(SO4)3
C.Mg(HCO3)2、CaCl2
D.Na2SiO3、HCl
解析:A项中反应为Ba(HCO3)2+2NaHSO4===Na2SO4+BaSO4↓+2H2O+2CO2↑,既有沉淀产生,又有气体放出;B项中离子反应为Al3++3HCO===Al(OH)3↓+3CO2↑,既有沉淀产生,又有气体放出;D项中SiO+2H+===H2SiO3↓,有沉淀产生.
答案:C
1.铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中铝的含量超过国家标准就会对人体造成危害.下列关于铝元素的说法正确的是( )
A.铝在空气中不易氧化是因为性质不活泼
B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物
C.明矾可用于饮用水的杀菌消毒
D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水
解析:铝在空气中会与O2反应生成致密的氧化物薄膜.C项中明矾溶于水生成氢氧化铝胶体,具有吸附色素和杂质的性能,通常用作净水剂,但不能用于杀菌消毒.铵盐都易溶于水.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com