
题目列表(包括答案和解析)
14.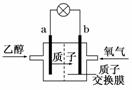 (2010·东北三校高三第一次联合模拟考试理综)乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为: C2H5OH+3O2===2CO2+3H2O下列说法错误的是( )
(2010·东北三校高三第一次联合模拟考试理综)乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为: C2H5OH+3O2===2CO2+3H2O下列说法错误的是( )
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a为负极,电极反应式是C2H5OH+3H2O+12e-===2CO2+12H+
D.b为正极,电极反应式是4H++O2+4e-===2H2O
解析:由图和C2H5OH+3O2===2CO2+3H2O可知,a是负极,b是正极,正极反应式是4H++O2+4e-===2H2O,负极反应式为C2H5OH+3H2O-12e-===2CO2+12H+.
答案:C
13.(2010·湖南师大附中高三第七次月考)向体积 为Va的0.1 mol·L-1 HCl溶液中加入体积为Vb的0.1 mol·L -1氨水,下列关系错误的是( )
为Va的0.1 mol·L-1 HCl溶液中加入体积为Vb的0.1 mol·L -1氨水,下列关系错误的是( )
A.Va<Vb时:c(NH3·H2O) +c(NH)>c(Cl-)
B. Va>Vb时:c(NH)>c(Cl-)>c(H+)>c(OH-)
C. Va=Vb时:c(NH3·H2O)+c(OH-)=c(H+)
D.
Va与Vb任意比时:c(NH)+c(H+)=c(OH-)+c(Cl-)
解析:A中Va<Vb时,碱过量,元素n(N)>n(Cl),故c(NH3·H2O) +c(NH)>c(Cl-).B项溶液电荷不守恒错误.C项为质子守恒式,D为电荷守恒式.
答案:B
12.某同学按下图所示的装置进行实验. A 、 B 为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO从右向左移动.下列分析正确的是 ( )
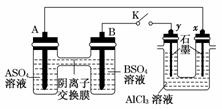
A.溶液中A2+浓度减小
B.B 的电极反应: B-2e-===B2+
C.y电极上有H2产生,发生还原反应
D.反应初期, x电极周围出现白色胶状沉淀,不久沉淀溶解
解析:当K闭合时,在交换膜处SO从右向左移动.说明A是负极,溶液中A2+浓度将会增大,B电极上发生还原反应,y电极是阳极,不可能产生H2.
答案: D
D
11.(2010·揭阳市第二次高考模拟)可逆反应aA(g)+bB(s)  cC(g)+dD(g).在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC(g)+dD(g).在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
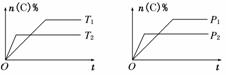
A.温度降低,化学平衡向逆反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.无法根据图像确定改变温度后化学平衡移动方向
解析:根据左图所示,T2时达到平衡所需时间短,说明温度T2比T1高,因此降低温度平衡正向移动.加入催化剂,不会移动平衡.根据右图所示,P2时达到平衡所需时间短,说明压强P2比P1大,再分析纵坐标,可以看出压强越大C的物质的量分数越小,即增大压强平衡向n(C) %减小的逆向移动,即a<c+d.
答案:C
10.下列说法正确的是( )
A.25℃时,pH为9的Na2CO3溶液和pH为5的NaHSO4溶液中,水的电离程度相同
B.在含有Al3+的KNO3溶液中,可通过加热的方法除去Al3+,证明盐的水解是吸热反应
C.已知HF的酸性比HCN的酸性强,则等体积等浓度NaF和NaCN两溶液中阳离子的物质的量之和相等
D.等物质的量浓度的① NH4Cl ② NH4HSO4 ③ Na2S④ NaNO3 ⑤(NH4)2SO4,其pH由大到小的排列为③>④>⑤>①>②
解析:可水解的盐促进水的电离,酸抑制水的电离.故A错.HF的酸性比HCN的酸性强,等浓度NaF和NaCN则水解程度NaF比NaCN弱,从电荷守恒式可以知道体积等浓度NaF中阳离子比NaCN溶液中阳离子的物质的量之和大.D项pH由大到小的排列为③>④>①>⑤>②,D错.
答案:B
9.(2010·龙岩市高三第二次质检)燃料电池是燃料(如CO,H2,CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2↑+6H2O
C.随着放电的进行,溶液的pH值不变
D.放电时溶液中的阴离子向负极移动
解析:得电子发生还原反应是正极,失去电子发生氧化反应是负极.O2+2H2O+4e-===4OH-应为正极反应式.燃料氧化生成的二氧化碳不可能从强碱溶液中逸出,它将进一步反应转化成碳酸根.所以负极反应式为:CH4+10OH--8e-===CO+7H2O.由于部分碱液和二氧化碳反应,所以溶液的pH值将减小.放电时溶液中的阴离子OH-向负极移动.
答案:D
8.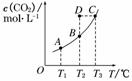 (2010·泰安市高三第二次质量检测)在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)
(2010·泰安市高三第二次质量检测)在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)  CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
A.
反应CO(g)+H2O(g)  CO2(g)+H2(g)的 ΔH>0
CO2(g)+H2(g)的 ΔH>0
B. 在T2时,若反应处于状态D,则一定有v正<v逆
C. 平衡状态A与C相比,平衡状态A的c(CO)小
D. 升高温度平衡向正反应方向移动
解析:从图片可以看出,上述反应的正反应是吸热反应,升高温度平衡向正反应方向移动,所以A正确,D正确.在T2时,若反应处于状态D,由D到B过程中,CO2浓度减小,平衡向逆反应方向移动 , 一定有v正<v逆,B正确,平衡状态A与C相比,平衡状态A的CO2浓度小,相应的c(CO)大,C错.
答案:C
7.(2010·东北三省四市高中毕业班第二次联合考试)T℃时,将体积为VA L、浓度为a mol/L 的一元酸HA与体积为VB L、浓度为b mol/L的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是( )
的一元酸HA与体积为VB L、浓度为b mol/L的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是( )
A.混合液的pH=7 B.a=b
C.混合液中KW=[c(H+)]2 D.a=b,VA=VB
解析:T℃时HA与BOH混合后恰好呈中性,说明溶液中c(H+)=c(OH)-,但溶液的pH不一定等于7,而KW=c(H+)·c(OH-)=[c(H+)]2;由于不知道a、b关系,故无法确定VA和VB的大小关系.即本题答案是C.
答案:C
6.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.061 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
解析:由主要化合价为+2价知,L、Q为第ⅡA族元素,又r(L)>r(Q),所以L为Mg元素,Q为Be元素;由主要化合价+3价及r(L)>r(M)>r(Q)知,M与L同周期且为第ⅢA族Al元素;由主要化合价为+6、-2价知,R为ⅥA族元素,又r(Q)>r(R)知,R为第三周期硫元素;由主要化合价为-2价,r(T)<r(R)知,T为第二周期第ⅥA族氧元素.A项中由于水分子间存在氢键,氢化物的沸点H2T>H2R(H2O>H2S),故A错误;B项中单质与盐酸反应速率,Mg>Be,故B项错误;C项中三氧化二铝是两性氧化物,故C正确;D项中Mg2+与S2-电子数不等,故D错误.
答案:C
5.化学在工业生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.铁表面镀铜,铁作阳极
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-===4OH-
D.在轮船外壳上镶入锌块,可减缓船体的腐蚀速率
解析:铁表面镀铜时,铜作阳极,铁作阴极,铜的盐溶液作电解质.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com