
题目列表(包括答案和解析)
6.(2010·郑州模拟)某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1.下列有关元素X的说法错误的是( )
A.元素X不可能是金属元素
B.元素X的气态氢化物不一定是电解质
C.元素X一定能形成化学式为KXO3的含氧酸钾盐
D.工业上制取X的单质时一定采用氧化还原反应
解析:题目中的X元素有两种可能,是N元素或Cl元素.工业上制取N2并不采用氧化还原的方法,D错误.
答案:D
5.下列叙述中正确的是( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
解析:短周期元素的最高正化合价一般等于其最外层电子数即族序数,但F元素无正价,O元素无最高正价,A项错误;除短周期外,第4、5周期均有18种元素,但第6周期有32种,第7周期尚未排满,B项错误;碱金属元素是指Li、Na、K、Rb、Cs、Fr元素,并不包括ⅠA族的氢元素,D项错误.
答案:C
4.下列排列顺序正确的是( )
①稳定性:HF>H2O>N H3
H3
②离子半径:Na+>Mg2+>F-
③酸性:盐酸>碳酸>醋酸
④结合质子能力:OH->C6H5O->HCO
A.①③ B.②④
C.①④ D.②③
解析:非金属性:F>O>N,因此氢化物稳定性:HF>H2O>NH3,①正确;Na+、Mg2+、F-具有相同的电子层结构,根据相同电子层结构的离子,核电荷数越大,半径越小,因此离子半径:F->Na+>Mg2+,②错误;酸性:盐酸>醋酸>碳酸,③错误;由于酸性:H2CO3>苯酚>水,因此结合质子能力:OH->C6H5O->HCO,④正确.
答案:C
3.A、B都是短周期元素,原子序数:B>A,它们可以形成化合物A2B.由此可得出的正确判断是( )
A.A、B肯定不在同一周期
B.A在B的前一周期
C.A肯定是金属元素
D.以上说法均不正确
解析:若A为Li,B为O,则在同一周期,A和B错误;若化合物为N2O,则选项C错误.
答案:D
2.下列叙述正确的是( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.化合反应和置换反应均属于氧化还原反应
解析:还原能力的强弱决定于失去电子的难易,而不是失去电子数目的多少,A项错误;Fe3+被还原后得到Fe2+,B项错误;有单质参加的化合反应才属于氧化还原反应,D项错误.
答案:C
1.某元素的一个原子形 成的离子可表示为Xn-,下列说法正确的是( )
成的离子可表示为Xn-,下列说法正确的是( )
A.Xn-含有的中子数为a+b
B.Xn-含有的电子数为a-n
C.X原子的质量数为a+b+n
D.X原子的质量约为 g
解析:Xn-中a表示质子数,b表示质量数,n-表示得到n个电子,则含有的中子数为b-a,电子数为a+ n.1 mol Xn-的质量约为b g,则1个X原子的质量约为 g.
n.1 mol Xn-的质量约为b g,则1个X原子的质量约为 g.
答案:D
5.(2010·天津高考)X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是__________________(用元素符号表示).
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________.
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族2-5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号).
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
解析:本题考查元素推断、元素周期律、反应热的知识.由蛋白质的元素组成可知,X、Y、Z、L分别是氢、碳、氮、氧元素;M是地壳中含量最高的金属元素,即为铝元素.(1)氢是元素周期表中原子半径最小的元素,碳、氮、氧同周期,从左往右原子半径逐渐减小,铝处于碳元素的左下角,故原子半径最大.(2)氮、氢按原子数目比1∶3形成氨分子,而写N2H4的结构式可以从H2O2的结构式得到启示.(3)从氧族元素原子序数之差可知,Se的原子序数为:8+8+18=34,Se的最高化合价为+6价,故其最高价氧化物对应的水化物是H2SeO4(或由H2SO4分析).同主族从上到下非金属性逐渐减弱,与H2化合能力逐渐减弱,故b项为生成1 mol硒化氢的反应热.
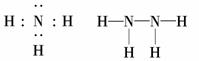 答案:(1)O 第3周期第ⅢA族 Al>C>N>O>H
答案:(1)O 第3周期第ⅢA族 Al>C>N>O>H
(2)
(3)34 H2SeO4 b
[发展等级评价]
(限时45分钟,满分100分)
4.(2010·江苏高考)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法不正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE含有相同类型的化学键
解析:B元素原子的最外层电子数是其电子层数的2倍,则B为碳元素;C元素的原子序数大于6,且在同周期主族元素中原子半径最大,故C为钠元素;D元素的合金是日常生活中的常用金属材料(如硬铝),则D为铝元素,第三周期元素E的单质常温下呈气态为Cl2,所以E为氯元素.原子序数小于6的A元素能形成气态单质,则A为氢元素.化合物HCl和NaCl中含有的化学键类型不同.
答案:D
3. (2010·西安模拟)短周期元素X、Y、Z在周期表中的位置如图所示,下列说法正确的是( )
(2010·西安模拟)短周期元素X、Y、Z在周期表中的位置如图所示,下列说法正确的是( )
A.X的非金属性最强
B.X单质的熔点比Z低
C.Z的氢化物的稳定性比Y强
D.Y的最高正化合价为+7
解析:根据三种元素的相对位置推断X为He、Y为F、Z为S.三种元素中F的非金属性最强,A错误;氦气的熔点比硫的低,B正确;HF的稳定性强于H2S,C错误;F元素没有正化合价,D错误.
答案:B
2.(2010·唐山模拟)下列说法中错误的是( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.除氦外的稀有气体原子的最外层电子数都是8
C.元素周期表中ⅢA族元素不都是金属元素
D.同一元素的各种同位素的化学性质均相同
解析:阳离子核外电子层数比其元素所在周期数小1,A错误.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com