
题目列表(包括答案和解析)
2.研究下表信息可直接得出的结论是( )
|
元素 |
F |
Cl |
Br |
I |
|
氢化物组成 |
HF |
HCl |
HBr |
HI |
|
氢化物形成难易程度 |
H2、F2混合,冷暗处剧烈化合并发生爆炸 |
H2、Cl2混合,光照或点燃时发生爆炸 |
H2与Br2混合,加热发生化合 |
H2、I2混合,加热化合,同时又分解 |
|
氢化物热稳定性 |
很稳定 |
稳定 |
较稳定 |
较不稳定 |
A.元素的性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数的递增而增强
C.ⅦA族元素的金属性随电子层数的增加而减弱
D.ⅦA族元素的非金属性随电子层数的增加而减弱
解析:表格中反映的是第ⅦA元素非金属性的递变规律,随 着原子序数的增加,元素的非金属性逐渐减弱.
着原子序数的增加,元素的非金属性逐渐减弱.
答案:D
1.中国科学技术名词审定委员会公布:111号元素(符号为Rg)的中文名称为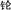 ,以此来纪念科学家伦琴诞辰111周年.第111号元素的某种核素的质量数为272.下列关于第111号元素的叙述正确的是( )
,以此来纪念科学家伦琴诞辰111周年.第111号元素的某种核素的质量数为272.下列关于第111号元素的叙述正确的是( )
A.原子核内有111个中子
B.位于元素周期表的第6周期
C.原子中子数与核外电子数的差为50
D.和第110号元素互为同位素
解析:111号元素的质子数为111,中子数为272-111=161,原子中中子数与核外电子数差为161-111=50,此元素位于元素周期表中第7周期,该原子与110号元素的质子数不同,二者不互为同位素.
答案:C
14.(10分)(2010·德阳模拟)A、B、C、D、E、F均为短周期元素,其原子序数逐渐增大.A、B、C三种元素原子核外电子层数之和为5.A、B两种元素的原子最外层电子数之和等于C元素原子最外层的电子数;B元素原子最外层的电子数是其电子层数的2倍,B与D的质子数之比为3∶4.A和C可以形成化合物CA3.E与D同主族,E与F同周期且原子半径是E>F.
回答下列问题:
(1)B的最高价氧化物的电子式为_____________________________________________.
(2)化合物C2A2分子中各原子的最外层均达到稳定结构,该分子的结构式为________________________________________________________________________.
(3)能说明E、F的非金属性强弱关系的化学方程式为
________________________________________________________________________.
(4)化合物A4C2D3的溶液呈酸性的离子方程式为
________________________________________________________________________.
解析:根据题给条件可推知,A为H元素,B为C元素,C为N元素,D为O元素,E为S元素,F为Cl元素.
(1)C元素的最高价氧化物为CO2,根据O===C===O可写出其电子式.
(2)N2H2中每个原子的最外层均达到稳定结构,即氮形成3对共用 电子,H形成1对共用电子,故其结构式为H-N==N-H.
电子,H形成1对共用电子,故其结构式为H-N==N-H.
(3)根据Cl2能氧化-2价的硫化物生成硫单质,即可证明Cl的非金属性比S强,如反应:Cl2+H2S===2HCl+S↓等.
 (4)NH4NO3溶液呈酸性是NH水解所致:NH+H2O NH3·H2O+H+.
(4)NH4NO3溶液呈酸性是NH水解所致:NH+H2O NH3·H2O+H+.
答案:(1)  ?
?
(2)H-N===N-H
(3)Cl2+H2S===2HCl+S↓
(4)NH+H2O NH3·H2O+H+
NH3·H2O+H+

13.(15分)(2010·福建高考)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表:J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
|
|
J |
|
|
|
|
|
|
|
R |
|
(1)M的离子结构示意图为________;元素T在周期表中位于第________族.
(2)J和氢组成的化合物分子有6个原子,其结构简式为________.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________________________________________________________.
(4)L的最简单气态氢化物甲的水溶液显碱性.
在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________________________.
(5)由J、R形成的液态化合物JR20.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ.该反应的热化学方程式为___________________________________.
 解析:本题考查元素的推断,意在考查考生的分析推断能力.根据J元素最低负化合价的绝对值与其原子最外层电子数相等,则J的最低负价为-4,位于ⅣA族,又五种元素均为短周期主族元素,则J为C,R为S,T的原子序数比R大,则T
解析:本题考查元素的推断,意在考查考生的分析推断能力.根据J元素最低负化合价的绝对值与其原子最外层电子数相等,则J的最低负价为-4,位于ⅣA族,又五种元素均为短周期主族元素,则J为C,R为S,T的原子序数比R大,则T 只能为Cl;根据M是地壳中含量最多的金属元素,则M为Al.(1)Al3+的结构示意图为
,Cl位于元素周期表第ⅦA族.(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2.(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾.(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3.结合提供信息,可以推断NH3和H2O2反应生成N2和H2O.
只能为Cl;根据M是地壳中含量最多的金属元素,则M为Al.(1)Al3+的结构示意图为
,Cl位于元素周期表第ⅦA族.(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2.(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾.(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3.结合提供信息,可以推断NH3和H2O2反应生成N2和H2O.
答案:(1) ⅦA (2)CH2===CH2
(3)AlCl3+3H2O===Al(OH)3+3HCl↑
(4)2NH3·H2O+3H2O2===N2↑+8H2O(或2NH3+3H2O2===N2↑+6H2O)
(5)CS2(l)+O2(g)===CO2(g)+SO2(g);
ΔH=-215 kJ·mol-1
12.(13分)(2010·石家庄模拟)(1)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式________________________.
(2)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式________________________________.
(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是________________(用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式________________________________.
(4)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物与NaOH溶液反应的离子方程式:_________________ ___________________________.
___________________________.
解析:(1)元素甲是第三周期ⅦA族元素,则为Cl元素,与另两种非金属元素可形成离子化合物,则应该是与NH形成NH4Cl.
(2)所有气态氢化物中最稳定的是HF,则元素F的单质与水反应的化学方程式为:2F2+2H2O===4HF+O2.
(3)检验二氧化碳气体常用澄清石灰水,则金属元素丙为Ca,它的离子半径比Cl-半径小,即为r(Ca2+)<r(Cl-);元素丁的原子序数比丙小8,则为Mg元素,它的单质在二氧化碳中燃烧的化学方程式为:2Mg+CO22MgO+C.
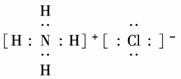 (4)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3.它能与强碱发生反应生成AlO.
(4)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3.它能与强碱发生反应生成AlO.
答案:(1)
(2)2F2+2H2O===4HF+O2
(3)r(Cl-)>r(Ca2+) 2Mg+CO22MgO+C
(4)Al(OH)3+OH-===AlO+2H2O
11.(12分)下表是元素周期表的一部分,表中数字序号各代表一种元素.
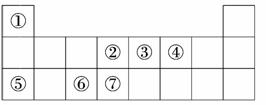
回答下列问题:
(1 )画出元素②的原子结构示意图________.
)画出元素②的原子结构示意图________.
(2)2009年诺贝尔物理学奖授予“光纤之父”--中国香港科学家高锟.制造光纤的材料由上表中________和________元素组成(填写上表中的序号).
(3)③④⑦三种元素的气态氢化物按稳定性由强到弱的顺序排列为:______________________________________________________________(用分子式表示).
 (4)元素⑥的最高价氧化物溶解于①④⑤三种元素组成的化合物的溶液中,离子方程式为________________________________________________________________________.
(4)元素⑥的最高价氧化物溶解于①④⑤三种元素组成的化合物的溶液中,离子方程式为________________________________________________________________________.
解析:(1)元素②为C,其原子结构示意图为 .
(2)光纤的主要成分为SiO2,由Si和O两种元素组成.
(3)元素③、④、⑦分别为N、O、Si,非金属性:O>N>Si,因此气态氢化物稳定性:H2O>NH3>SiH4.
 (4)元素⑥为Al,其最高价氧化物为Al2O3,元素①、④、⑤分别为H、O、Na,组成的化合物为NaOH,Al2O3溶于NaOH溶液的离子方程式为Al2O3+2OH-===2AlO+H2O.
(4)元素⑥为Al,其最高价氧化物为Al2O3,元素①、④、⑤分别为H、O、Na,组成的化合物为NaOH,Al2O3溶于NaOH溶液的离子方程式为Al2O3+2OH-===2AlO+H2O.
答案:(1)
(2)④ ⑦ (3)H2O>NH3>SiH4
(4)Al2O3+2OH-===2AlO+H2O
10.研究下 表信息可直接得出的结论是( )
表信息可直接得出的结论是( )
|
元素 |
F |
Cl |
Br |
I |
|
氢化物组成 |
HF |
HCl |
HBr |
HI |
|
氢化物形成难易程度 |
H2、F2混合,冷暗处剧烈化合并发生爆炸 |
H2、Cl2混合,光照或点燃时发生爆炸 |
H2与Br2混合,加热发生化合 |
H2、I2混合,加热化合,同时又分解 |
|
氢化物热稳定性 |
很稳定 |
稳定 |
较稳定 |
较不稳定 |
A.元素的性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数的递增而增强
C.ⅦA族元素的金属性随电子层数的增加而减弱
D.ⅦA族元素的非金属性随电子层数的增加而减弱
解析:表格中反映的是第ⅦA族元素非金属性的递变规律,随着原子序数的递增,元素的非金属性逐渐减弱.
答案:D
9.(2010·南昌模拟)太阳能电池板可将太阳能直接转化为电能,我国在砷化镓太阳能电池研究方面国际领先.砷(As)和镓(Ga)都是第四周期元素,分别属于VA和ⅢA族.下列有关说法正确的是( )
A.As的非 金属性强于P
金属性强于P
B.AsH3的沸点低于PH3
C.Ga的原子序数比Ca大1
D.太阳能电池不属于原电池
解析:As和P同主族,且位于P的下一周期,故非金属性P>As;AsH3相对分子质量大于PH3,均无氢键,所以AsH3的沸点高于PH3;Ca的原子序数为20,Ga的原子序数为31.
答案:D
8.如图是元素周期表的另一种形式.下列有关叙述正确的是( )

A.图中标明的元素均为主族元素
B.图中①号元素的一种碳化物与水反应可生成乙炔
C.图中②号元素的最高价氧化物既能溶于强酸又能溶于强碱
D.图中P的氢化物的电子式为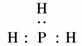
解析:题图中的He、Ne、Ar等稀有气体为0族元素;图中①号元素为Ca,CaC2与水反应生成氢氧化钙与乙炔;图中②号元素为Si,其最高价氧化物为SiO2,能溶于强碱,但不能溶于强酸;图中P的氢化物的电子式为 .
.
答案:B
7.(2010·潍坊模拟)已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A.气态氢化物的稳定性:D>C
B.原子序数:B>A>C>D
C.最高价氧化物对应水化物的碱性:B>A
D.四种元素一定属于短周期元素
解析:根据四种离子具有相同的电子层结构,C、D同周期,C的最外层电子数大于D的最外层电子数,A、B同周期,B的最外层电子数大于A的最外层电子数,且A、B位于C、D的下一周期,原子序数B>A>C>D,B正确;非金属性C>D,故气态氢化物稳定性C>D,A错误;金属性A>B,故最高价氧化物对应水化物的碱性A>B,C错误;当A、B分别为K、Ca时,则为长周期元素,D错误.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com