
题目列表(包括答案和解析)
2.下列叙述不正确的是( )
A.电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应
B.电解法精炼铜时,纯铜作阴极,Cu2+发生还原反应
C.电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液
D.铜锌原电池中,锌作负极,电子从锌极流向铜极
解析:用Fe作阳极电解饱和食盐水时,阳极反应式为:Fe-2e-===Fe2+,而溶液中Cl-不再发生氧化反应.
答案:A
1.钢铁发生电化学腐蚀时,负极发生的反应是( )
A.2H++2e-===H2↑
B.Fe-2e-===Fe2+
C.2H2O+O2+4e-===4OH-
D.4OH--4e-===2H2O+O2↑
解析:钢铁是铁碳合金,形成原电池时,负极发生氧化反应,其电极反应为Fe-2e-===Fe2+.
答案:B
5.(2010·全国卷Ⅱ)下图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8-8.0,酸色--红色,碱色--黄色)
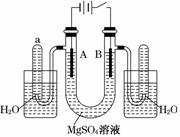
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是________(填编号);
①A管溶液由红变黄 ②B管溶液由红变黄
③A管溶液不变色 ④B管溶液不变色
(2)写出A管中发生反应的反应式:__________________________________________
________________________________________________________________________;
(3)写出B管中发生反应的反应式:_____________________________________________
________________________________________________________________________;
(4)检验a管中气体的方法是___________________________________________________
________________________________________ ________________________________;
________________________________;
(5)检验b管中气体的方法是__________________________________________________
________________________________________________________________________;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是________________
_ _______________________________________________________________________.
_______________________________________________________________________.
解析:根据图可以确定,A极为阴极,B极为阳极.A极H+放电,A极附近OH-增加,溶液碱性增强,A极附近溶液变黄色,同时Mg2+与OH-结合生成Mg(OH)2沉淀;B极OH-放电,使得溶液中H+增加,B极附近溶液显酸性,溶液仍为红色.电解后,将电解液倒入烧杯中,A极附近生成的Mg(OH)2与B极附近生成的H2SO4反应,生成MgSO4,即沉淀溶解,溶液呈红色.根据上述分析,a中收集的是氢气,b中收集的是O2.
答案:(1)① ④
(2)2H++2e-===H2↑(写2H2O+2e-===2OH-+H2↑同样给分),Mg2++2OH-===Mg(OH)2↓
(3)4OH--4e-===2H2O+O2↑(写2H2O-4e-===4H++O2↑同样给分)
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内会复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
[发展等级评价]
(限时45分钟,满分100分)
4.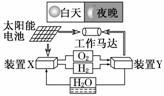 (2010·江苏高考)右图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
(2010·江苏高考)右图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:
O2+2H2O+4e-===4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
解析:本题考查能量转换的知识,意在考查考生综合运用原电池、电解池原理的能力.A项,该系统中存在太阳能与电能、电能与机械能、化学能与电能、电能与化学能等4种形式的能量转化关系,不正确;B项,装置Y是将化学能转化为电能的燃料电池装置,负极应该是H2发生氧化反应,故不正确;C项,装置X为电解水产生氢气和氧气,故正确;D项,装置X、Y形成的子系统可以实现物质的零排放,但不可能实现化学能与电能间的完全转化,能量总是有损失的,故不正确.
答案:C
3.(2010·莆田模拟)下列有关金属腐蚀与防护的说法,正确的是( )
A.纯银器表面在空气中因发生电化学腐蚀渐渐变暗
B.当镀锌铁制品的镀层破损时,镀层不再对铁制品起保护作用
C.在空气与水面交接处的钢柱,比在水下部分的钢柱容易腐蚀
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
解析:纯银器在空气中主要发生化学腐蚀,A错;镀锌铁制品的镀层破损时容易发生电化学腐蚀,此时锌作为负极被腐蚀,而铁作为正极被保护,B错;在空气与水面交接处的钢柱比在水下部分的钢柱接触空气充分,因此容易腐蚀,C对;将地下输油钢管与外加直流电源的正极相连,钢管作为阳极被腐蚀,D错.
答案:C
2.(2010·东城模拟)下列有关电化学的示意图中正确的是( )
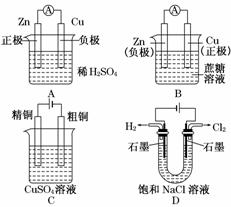
解析:选项A,Zn应为原电池负极,Cu为原电池正极.选项B,蔗糖为非电解质,不能构成原电池.选项C,粗铜应连接电源正极.选项D,电解饱和NaCl溶液,Cl-在阳极放电产生Cl2,溶液中的H+在阴极获得电子而产生H2,正确.
答案:D

[基础等级评价]
1.(2010·海南高考)利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu===Cu2++2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
解析:电解精炼铜时,粗铜作阳极,精铜作阴极,活泼性比铜弱的金属沉积在电解糟底部形成阳极泥.
答案:D
5.(2010·崇文模拟)A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
|
元素 |
原子结构或性质 |
|
A |
原子最外层电子数是内层电子总数的1/5 |
|
B |
形成化合物种类最多的元素,其单质为固体 |
|
C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
|
D |
地壳中含量最多的元素 |
|
E |
与D同主族 |
|
F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是___________________;A与E形成的化合物的电子式是________________.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是________________________________________________________________________________________________________________________________________________.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是_____
________________________________________________________________________.
(4)F的盐酸盐水溶液呈酸性,原因是_____________________________________(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式:__________________________________________________________________.
解析:由题给信息推出A为Mg元素;B为C元素;C为Fe元素;D为O元素;E为S元素;F为Al元素.
(1)A(Mg元素)在周期表中位于第三周期ⅡA族,A与E形成的化合物的电子式为Mg2+ .
.
 (2)FeCl3的浓溶液腐蚀铜的离子方程式为:2Fe3++Cu===2Fe2++Cu2+.(3)C与水反应的化学方程式为:C+H2O(g)CO+H2.(4)AlCl3溶液呈酸性是因为Al3+的水解,离子方程式为Al3++3H2O
(2)FeCl3的浓溶液腐蚀铜的离子方程式为:2Fe3++Cu===2Fe2++Cu2+.(3)C与水反应的化学方程式为:C+H2O(g)CO+H2.(4)AlCl3溶液呈酸性是因为Al3+的水解,离子方程式为Al3++3H2O Al(OH)3+3H+;C、D形成的相对分子质量为160的化合物为Fe2O3,则发生铝热反应的化学方程式为2Al+Fe2O32Fe+Al2O3.
Al(OH)3+3H+;C、D形成的相对分子质量为160的化合物为Fe2O3,则发生铝热反应的化学方程式为2Al+Fe2O32Fe+Al2O3.
答案:(1)第3周期ⅡA族 Mg2+
(2)2Fe3++Cu===2Fe2++Cu2+
(3)C+H2O(g)CO+H2
(4)Al3++3H2O Al(OH)3+3H+ 2Al+Fe2O32Fe+Al2O3
Al(OH)3+3H+ 2Al+Fe2O32Fe+Al2O3
4.下列有关叙述:①非金属单质M能从N的化合物中置换出非金属单质N;②M原子比N原子容易得到电子;③单质M跟H2反应比N跟H2反应容易得多;④气态氢化物水溶液的酸性HmM>HnN;⑤氧化物水化物的酸性HmMOx>HnNOy;⑥熔点M>N.能说明非金属元素M比N的非金属性强的是( )
A.②⑤ B.①②③
C.①②③⑤ D.全部
解析:④中气态氢化物水溶液的酸性与元素非金属性强弱无关;⑤中应为“最高价氧化物水化物的酸性”;⑥中熔点高低与元素非金属性强弱无关.
答案:B
3.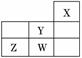 (2010·西城模拟)短周期元素W、X、Y、Z在元素周期
(2010·西城模拟)短周期元素W、X、Y、Z在元素周期 表中的位置如
表中的位置如
右图所示.下列说法中,正确的是( )
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
解析:根据四种元素在周期表中的相对位置关系,可以推断X 为He,Y为F,Z为S、W为Cl.Cl的最高价氧化物对应的水化物HClO4是强酸,A对;同周期元素从左到右原子半径逐渐减小,因此Y的原子半径在同周期主族元素中最小,B错;同周期元素从左到右非金属性逐渐增强,因此非金属性W>Z,C错;S为ⅥA族元素,ⅥA族元素中O的气态氢化物最稳定,D错.
为He,Y为F,Z为S、W为Cl.Cl的最高价氧化物对应的水化物HClO4是强酸,A对;同周期元素从左到右原子半径逐渐减小,因此Y的原子半径在同周期主族元素中最小,B错;同周期元素从左到右非金属性逐渐增强,因此非金属性W>Z,C错;S为ⅥA族元素,ⅥA族元素中O的气态氢化物最稳定,D错.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com