
题目列表(包括答案和解析)
12.(12分)在25℃时,用石墨电极电解2.0 L 2.5 mol/L CuSO4溶液,如有0.20 mol电子发生转移,试回答下列问题:
(1)阴极发生________反应,电极反应为_________________________________________
________________________________________________________________________.
(2)阳极发生________反应,电极反应为________________________________________
________________________________________________________________________.
(3)电解后得到的Cu的质量是________,得到O2的体积(标准状况)是________,溶液的pH是________.
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差________,电解液的pH________(填“变小”“变大”或“不变”).
解析:用惰性电极电解CuSO4溶液时,阴极:2Cu2++4e-===2Cu,阳极:4OH--4e-===O2↑+2H2O,总反应:2CuSO4+2H2O2Cu+O2↑+2H2SO4.转移0.20 mol电子时,得到0.10 mol Cu,0.05 mol O2,溶液中的c(H+)==0.10 mol/L,所以溶液的pH为1.如用等质量的两块铜片代替石墨作电极,为电镀池,阳极损失0.10 mol Cu,阴极得到0.10 mol Cu,两极质量相差12.8 g,溶液的pH不变.
答案:(1)还原 2Cu2++4e-===2Cu
(2)氧化 4OH--4e-===2H2O+O2↑
(3)6.4 g 1.12 L 1
(4)12.8  g 不变
g 不变
11.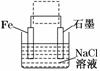 (8分)(2010·潍坊模拟)钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图所示:
(8分)(2010·潍坊模拟)钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图所示:
(1)写出石墨电极的电极反应式________________________________
________________________________________________________________________.
(2)将该装置作简单修改即可成为钢铁电化学防护的装置,请在图中虚线框内所示位置作出修改,并用箭头标出导线中电子流动的方向.
(3)写出修改后石墨电极的电极反应式_________________________________________.
解析:(1)钢铁的吸氧腐蚀中石墨作正极,电极反应式为:2H2O+O2+4e-===4OH-.(2)利用外加电源的阴极保护法,将钢铁与直流电源的负极相连接,可以保护钢铁不被腐蚀.(3)修改后的装置为电解池,石墨电极作阳极,Cl-放电,电极反应式为:2Cl--2e-===Cl2↑.
答案:(1)2H2O+O2+4e-===4OH-
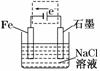
(2)
(3)2Cl--2e-===Cl2↑
10.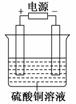 如图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解.下列说法正确的是( )
如图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解.下列说法正确的是( )
|
序号 |
电极材料 |
通电后的变化 |
|
|
阴极 |
阳极 |
||
|
A |
石墨 |
石墨 |
阴极质量增加,溶液的pH增大 |
|
B |
铜 |
铜 |
阳极质量减小,阴极质量增加 |
|
C |
铁 |
铁 |
两极的质量不发生变化 |
|
D |
铂 |
铁 |
阴极质量增加,溶液的pH恒定不变 |
解析:A项,阳极反应式为4OH--4e-===O2↑+2H2O,溶液中有H2SO4生成,pH减小,阴极反应式为Cu2++2e-===Cu,阴极质量增加;B项,构成电镀装置,阳极反应式为Cu-2e-===Cu2+,阴极反 应式为Cu2++2e-===Cu,阳极质量减小,阴极质量增加;C项,阳极反应式为Fe-2e-===Fe2+,阴极反应式为Cu2++2e-===Cu,阳极质量减小,阴极质量增加;D项,阳极反应式为Fe-2e-===Fe2+,阴极反应式为Cu2++2e-===Cu,阴极质量增加,由于Fe2+和Cu2+水解能力有差异,因此溶液pH变化无法确定.
应式为Cu2++2e-===Cu,阳极质量减小,阴极质量增加;C项,阳极反应式为Fe-2e-===Fe2+,阴极反应式为Cu2++2e-===Cu,阳极质量减小,阴极质量增加;D项,阳极反应式为Fe-2e-===Fe2+,阴极反应式为Cu2++2e-===Cu,阴极质量增加,由于Fe2+和Cu2+水解能力有差异,因此溶液pH变化无法确定.
答案:B
9.(2010·海淀模拟)高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车.总反应方程式如下:Ni(OH)2+M NiOOH+MH,下列叙述正确的是( )
NiOOH+MH,下列叙述正确的是( )
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M+H2O+e-===MH+OH-
C.充电时阳极反应为:NiOOH+H2O+e-===Ni(OH) 2+OH-
2+OH-
D.放电时每转移1 mol电子,正极有1 mol NiOOH被氧化
解析:放电时正极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-,正极附近c(OH-)增大,溶液碱性增强,A对;放电时负极反应为MH+OH--e-===M+H2O,B错;充电时阳极反应为Ni(OH)2+OH--e-===NiOOH+H2O,C错;放电时正极发生还原反应,放电时每转移1 mol电子,正极上有1 mol NiOOH被还原,D错.
答案:A
8.(2010·湘潭模拟)根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
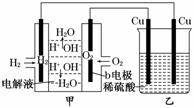
A.利用该反应可持续生产硫酸铜,直至硫酸耗尽
B.甲中b电极的电极反应为:4OH--4e-===2H2O+O2↑
C.通电初期乙中的总反应为:Cu+H2SO4CuSO4+H2↑
D.反应过程中甲、乙中溶液的pH都逐渐减小
解析:电解初期,乙中阳极铜失去电子变成Cu2+进入溶液中,阴极H+得到电子变成氢气,C项对;但当Cu2+增大到一定程度时,乙中Cu2+放电而不是H+放电,A项错;b电极上是氧气得到电子变成OH-,B项错;电解进行到一定程度时,乙中Cu2+浓度保持不变,pH不变,D项错.
答案:C
7.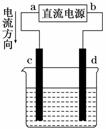 右图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
右图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
解析:电流从电源的正极流出,故a为电源的正极,b为电源的负极,与电源正极相连的c为阳极,与电源负极相连的d为阴极.在电解过程中,因Cu2+是阳离子,移向阴极(d),在阴极放电析出Cu,所以d电极质量增加;Cl-是阴离子,移向阳极(c),在阳极放电生成Cl2,会导致溶液中Cl-浓度降低.
答案:C
6.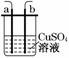 如右图所示,a、b两电极材料分别为铁丝和铜丝.则以下说法不正确的是( )
如右图所示,a、b两电极材料分别为铁丝和铜丝.则以下说法不正确的是( )
A.该装置可以构成原电池,也可以构成电解池
B.a电极可能发生反应:Cu2++2e-===Cu
C.b电极质量可能增加
D.该过程可能有大量气体产生
解析:该装置若用导线直接相连,则构成原电池,若与电源相连,则构成电解池,A正确;当a电极作电解池的阴极时,其电极反应为Cu2++2e-===Cu,B正确;当b电极作原电池的正极时,电极反应为Cu2++2e-===Cu,C正确.
答案:D
5.用铂作 电极电解下列溶液时,在阳极上有气体析出,且溶液的pH下降的是( )
电极电解下列溶液时,在阳极上有气体析出,且溶液的pH下降的是( )
A.KNO3 B.CuSO4
C.NaOH D.HCl
解析:由阴阳离子的放电顺序可知电解KNO3、NaOH溶液的实质都是电解水,电解质溶液的浓度均增大,KNO3溶液pH不变,NaOH溶液的pH增大;电解HCl溶液,阴极反应2H++2e-===H2↑,阳极反应2Cl--2e-===Cl2↑,电解的是HCl,电解质溶液的浓度降低,pH增大;电解CuSO4溶液,阴极反应2Cu2++4e-===2Cu,阳极反应4OH--4e-===O2↑+2H2O,电池反应是:2CuSO4+2H2O电解,2Cu+2H2SO4+O2↑,pH下降.
答案:B
4.(2010·安徽高考)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
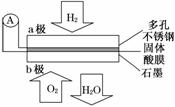
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-===4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
解析:该原电池的化学原理是H2被氧化,在负极(a极)发生反应:H2-2e-===2H+,H+由a极转移到b极,D项正确;O2发生还原反应,在正极(b极)发生反应:O2+4H++4e-===2H2O,则电子从a极流向b极,A、B两项不正确;C项因未指明气体所处的温度和压强 ,不正确.
,不正确.
答案:D
3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
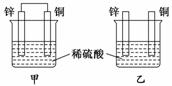
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
解析:甲装置构成原电池,锌片为负极,铜片为正极,溶液中的H+在铜片上获得电子产生成H2,乙装置中,溶液中的H+直接与Zn反应而产生H2.两装置溶液中的c(H+)浓度降低,pH增大.由于甲装置中Cu、Zn、稀H2SO4构成原电池,加快了电子转移速率,产生H2的速率比乙快.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com