
题目列表(包括答案和解析)
[基础等级评价]
1.(2010·厦门模拟)对H2O的电离平衡不产生影响的微粒是( )
A.CH3CH2OH B.NH
C.Cl2 D.S2-
解析:乙醇与水不反应,本身不电离也不水解,A正确;NH、S2-因发生水解而破坏水的电离平衡;Cl2与水反应生成HCl与HClO而破坏水的电离平衡.
答案:A
6.(2010·潍坊模拟)如图甲、乙是电化学实验装置.
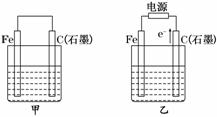
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为____________________________________________.
②乙中总反应的离子方程式为______________________________________________.
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为___________________________________________________________________.
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为_______________________________________________.
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________ g.
解析:(1)若两烧杯中均盛有NaCl溶液,则:①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-===4OH-.②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2OCl2↑+H2↑+2OH-.③Cl2和I2的物质的量之比为5∶1,生成HC l和HIO3.
l和HIO3.
(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe-2e-===Fe2+.②乙装置为电解池,电解反应为:2CuSO4+2H2O2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态.由电解反应式可知,2H+-CuO-CuCO3,电解后n(H+)=0.1×0.2=0.02(mol),故m(CuO)=0.02××80=0.8(g),m(CuCO3)=0.02××124=1.24(g).
答案:(1)①2H2O+O2+4e-===4OH-
②2Cl-+2H2OH2↑+Cl2↑+2OH-
③5Cl2+I2+6H2O===10HCl+2HIO3
(2)①Fe-2e-===Fe2+
②CuO(或CuCO3) 0.8(或1.24)
0.5 mol××64 g/mol=16 g.
答案:(1)①正 ②4OH--4e-===2H2O+O2↑
③水减少的质量:100 g×(1-)=4.5 g
生成O2的体积:××22.4 L/mol=2.8 L
④16
⑤碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大. 酸性增大,因为阳极上OH-生成O2,溶液中H+浓度增加. 酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行;因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
5.(2009·全国卷Ⅰ)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极.
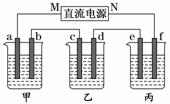
(1)接通电源,经过一段时间后,测得丙中K2SO4的浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为________________________________________________;
③列式计算电极b上生成的气体在标准状况下的体积:___________________________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液____________________________________________________________________;
乙溶液____________________________________________________________________;
丙溶液____________________________________________________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?________________
________________________________________________________________________
解析:(1)用石墨电极电解乙装置中的CuSO4溶液时,c电极质量增加,说明该电极上Cu2+获得电子生成单质铜,即c电极为电解池的阴极.
进一步推断:a为阴极,b为阳极,d为阳极,e为阴极,f为阳极,N为电源的正极,电极b上发生的电极反应为4OH--4e-===2H2O+O2↑
装置丙中实际上电解水,设电解后溶液的总质量为m.
则×100%=10.47%,m≈95.5 (g)
电解水的质量为100 g-95.5 g=4.5 g
n(H2O)==0.25 mol
线路中转移电子的物质的量为0.25 mol×2=0.5 mol
由b电极上的电极反应式可知产生O2的体积为
V(O2)=0.5 mol××22.4 L/mol=2.8 L
c电极上析出铜的质量为:
4.(2010·福建高考)铅蓄电池的工作原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是( )
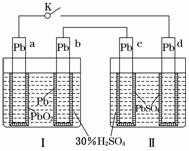
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中SO向c电极迁移
D.K闭合一段时间后, Ⅱ可单独作为原电池,d电极为正极
Ⅱ可单独作为原电池,d电极为正极
解析:根据图示,Ⅰ为原电池,a为正极,b为负极,Ⅱ为电解池,c为阴极,d为阳极.K闭合时,d为阳极,发生氧化反应:PbSO4-2e-+2H2O===PbO2+4H++SO,A项正确,根据铅蓄电池的总反应知该反应中转移电子数为2e-,则电路中转移0.2 mol电子时,Ⅰ中消耗0.2 mol H2SO4,B项正确;K闭合时,Ⅱ中SO向阳极(d极)迁移,C项错误;K闭合一段时间后,c电极析出Pb,d电极析出PbO2,电解质溶液为H2SO4,此时可以形成铅蓄电池,d电极作正极,D项正确.
答案:C
3.(2010·潍坊模拟)某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于 水.当K闭合时,SO从右向左通过交换膜移向A极.下列分析正确的是
( )
水.当K闭合时,SO从右向左通过交换膜移向A极.下列分析正确的是
( )
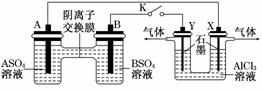
A.溶液中c(A2+)减小
B.B极的电极反应:B-2e-===B2+
C. Y电极上有H2产生,发生还原反应
Y电极上有H2产生,发生还原反应
D.反应初期,X电极周围出现白色胶状沉淀
解析:根据SO从右向左通过交换膜移向A极,则A极为负极,故A极的电极反应为A-2e-===A2+,溶液中c(A2+)增大,A错;B极为正极,发生得电子的还原反应,B错;Y电极为阳极,为Cl-放电,发生氧化反应:2Cl--2e-===Cl2↑,有Cl2产生,C错;右边U形管中最初为电解AlCl3溶液,X电极为H+放电,c(H+)减小,c(OH-)增大,且Al3+移向X极,因此会产生Al(OH)3白色胶状沉淀,D对.
答案:D
2.(2010·济南模拟)镍镉(Ni?Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O.有关该电池的说法中,不正确的是( )
Cd+2NiOOH+2H2O.有关该电池的说法中,不正确的是( )
A.放电时,电解质溶液中的OH-向负极移动
B.充电过程是电能转化为化学能的过程
C.放电时,负极附近溶液的碱性不变
D.充电时阴极反应为:Cd(OH)2+2e-===Cd+2OH-
解析:该电池放电时是原电池,电解质溶液中的OH-向负极移动,与Cd2+反应生成Cd(OH)2,负极附近溶液的碱性减弱.该电池充电时是电解池,是电能转化为化学能的过程,阴极Cd(OH)2发生还原反应生成Cd.
答案:C
1.能够实现反应Cu+2H2O===Cu(OH)2↓+H2↑的是( )
A.铜银合金在潮湿空气中发生电化学腐蚀
B.用铜片作阴极、石墨作阳极,电解饱和氯化钠溶液
C.用铜片作阳极、石墨作阴极,电解饱和氯化钠溶液
D.铜片作原电池的负极,石墨作原电池的正极,氯化钠溶液作电解质溶液
解析:Cu在金属活动性顺序中排在H的后面,故题设中的反应只能在电解池中发生.由于Cu被氧化,故Cu片作阳极,产物中有Cu(OH)2,则电解质溶液为中性或碱性溶液.
答案:C
14.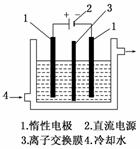 (18分)(2010·四川高考)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.
(18分)(2010·四川高考)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
请回答下列问题:
(1)碘是________(填颜色)固体物质,实验室常用________方法来分离提纯含有少量杂质的固体碘.
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
电解时,阳极上发生反应的电极反应式为________;阴极上观察到的实验现象是________________________________________________________________________.
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸.
|
实验方法 |
实验现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液―→―→②―→―→―→⑤―→碘酸钾晶体
步骤②的操作名称是________,步骤⑤的操作名称是________.步骤④洗涤晶体的目的是________________________________________________________________________.
解析:(1)卤素单质的颜色随着相对分子质量的增加而变深,单质碘为紫黑色,具有加热易升华的性质.
(2)电解时,阳极发生氧化反应,I-失去电子被氧化;阴极发生还原反应,H+得电子生成氢气.
(3)阳极电解产物中含有IO,该离子与I-在酸性条件下可以发生氧化还原反应生成单质碘,可用淀粉溶液检验生成的单质碘.
(4)溶液经蒸发浓缩,冷却后析出晶体,然后过滤得目标产物KIO3,洗涤其表面的杂质,干燥后即得较为纯净的KIO3.
答案:(1)紫黑色 升华
(2)2I--2e-===I2(或I-+6OH--6e-===IO+3H2O) 有气泡 产生
产生
(3)
|
实验方法 |
实验现象及结论 |
|
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝. |
如果不变蓝,说明无I-. (如果变蓝,说明有I-) |
(4)冷却结晶 干燥 洗去吸附在碘酸钾晶体上的氢氧化钾等杂质

13.(12分)(2010·山东高考)对金属制品进行抗腐蚀处理,可延长其使用寿命.
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是________________________(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________.
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为________.取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是________________________________________________________________________.
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是________.
 (3)利用右图装置,可以模拟铁的电化学防护.
(3)利用右图装置,可以模拟铁的电化学防护.
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处.若X为锌,开关K置于M处,该电化学防护法称为________.
解析:(1)①题中指出在碱洗时有气泡产生,则只有金属铝和碱反应才符合条件,故碱洗过程中发生反应的离子方程式为Al2O3+2OH-===2AlO+H2O、2Al+2OH-+2H2O===2AlO+3H2↑.碱洗后溶液中含有大量AlO,故最好通入CO2气体使AlO转化为Al(OH)3沉淀以回收铝.
②活泼金属作阳极,阳极材料本身失电子被氧化,其氧化产物为Al2O3,由此可得阳极反应式为2Al+3H2O===Al2O3+6 H++6e-.加入NaHCO3溶液后,Al3+与HCO发生水解相互促进反应,离子方程式可表示为Al3++3HCO===Al(OH)3↓+3CO2↑.
H++6e-.加入NaHCO3溶液后,Al3+与HCO发生水解相互促进反应,离子方程式可表示为Al3++3HCO===Al(OH)3↓+3CO2↑.
(2)电镀时若用石墨作阳极,则电解过程中电解液中Cu2+浓度不断减小,导致铁表面不能镀上均匀的铜.
(3)若X为碳棒,则只能用外加电源的阴极保护法,此时开关K应置于N处.若X为Zn,K置于M处,其保护原理称为牺牲阳极的阴极保护法.
答案:(1)①2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑(或:2Al+2OH-+2H2O===2AlO+3H2↑) b ②2Al+3H2O===Al2O3+6H++6e- HCO与H+反应使H+的浓度减小,产生Al(OH)3沉淀
(2)补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定
(3)N 牺牲阳极的阴极 保护法(或:牺牲阳极保护法)
保护法(或:牺牲阳极保护法)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com