
题目列表(包括答案和解析)
2.下列有关0.1 mol/L NaHCO3溶液中离子浓度的关系式,正确的是( )
A.c(Na+)>c(HCO)>c(CO)>c(H+)>c(OH-)
B.c(Na+)>c(CO)>c(HCO)>c(OH-)>c(H+)
C.c(Na+)=c(HCO)+2c(CO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)
解析:NaHCO3溶液中HCO既能电离又能水解,由于溶液显碱性,因此水解程度大于电离程度,离子浓度大小关系为:c(Na+)>c(HCO)>c(OH-)>c(H+)>c(CO),A、B错;根据物料守恒,c(Na+)=c(HCO)+c(CO)+c(H2CO3),C错;根据电荷守恒,c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),D对.
答案:D
1.(2010·南昌模拟)今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为V L;③pH=2的硫酸;④pH=12的氢氧化钠溶液.下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大10倍,所得溶液pH变为(a-1)
B.V1 L ③溶液和V2 L ④溶液混合,若混合后溶液pH=3,则V1∶V2=11∶9
C.①与④两溶液等体积混合,混合液pH=7
D.①与③两溶液的物质的量浓度相等
解析:A选项,碳酸钠溶液被稀释,水解程度增大,所以pH大于(a-1);C选项,①与④两溶液等体积混合后,溶质是醋酸与醋酸钠的混合物,且醋酸过量较多,溶液呈酸性;D选项,pH相等的硫酸与醋酸,醋酸物质的量浓度大于硫酸.
答案:B
14.(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
甲 |
乙 |
丙 |
丁 |
|
c(HA)(mol/L) |
0.2 |
c1 |
0.1 |
0.1 |
|
c(NaOH)(mol/L) |
0.2 |
0.2 |
0.1 |
0.1 |
|
混合溶液的pH |
=a |
=7 |
>7 |
=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:_______________________________________________________________
________________________________________________________________________;
(2)不考虑其他组的实验结果,从乙组情况分析,c1是否等于0.2 mol/L________(填“是”、“否”或“不一定”),混合溶液中c(A-)与c(Na+)的大小关系是________(填序号).
A.前者大 B.后者大
C.相等 D.无法判断
(3)丙组混合溶液中离子浓度由大到小的顺序是____________________________.
(4)丁组实验所得混合溶液中,c(Na+)-c(A-)=______ mol/L.
解析:(1)因NaOH是强碱,甲组中酸碱的物质的量相同,二者恰好完全反应,故溶液的酸碱性取决于A-能否水解,即取决于HA是强酸还是弱酸.
(2)若HA为强酸时,c1=0.2 mol/L时,pH=7;若HA为弱酸时,c1>0.2 mol/L时,才能使pH=7.依电荷守恒有:c(Na+)+c(H+)=c(A-)+c(OH-),溶液的pH=7时,c(A-)=c(Na+).
(3)丙组溶液中两者等物质的量反应后,溶液呈碱性,说明HA是弱酸,生成的强碱弱酸盐水解呈碱性.
(4)由盐溶液水解及水电离的相关知识可得水电离出的c(OH-)=10-5 mol/L,则丁组实验中c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9) mol/L.
答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)不一定 C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)(10-5-10-9)

13.(16分)(2010·桂林期末)Ⅰ.泡沫灭火器内含浓的NaHCO3溶液(置于铁桶内)和浓的Al2(SO4)3溶液(置于玻璃瓶内),使用时把灭火器倒置即有泡沫状物质喷出灭火.
(1)写出灭火器倒置时反应的离子方程式:_______________________________________
________________________________________________________________________.
(2)因Na2CO3价格便宜,有人建议用等物质的量浓度和等体积的Na2CO3溶液代替NaHCO3溶液,你认为此建议________(填“合理”或“不合理”),理由是_______________
________________________________________________________________________.
(3)有人建议:把浓Al2(SO4)3溶液置于铁桶内,而把固体NaHCO3置于玻璃瓶内,此建议________(填“妥当”或“不妥当”),其原因是____________________________________
________________________________________________________________________________________________________________________________________________.
Ⅱ.某温度下,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液a L与pH=1的H2SO4溶液b L混合.(设混合溶液体积为两者之和,固体体积忽略不计)
(1)若所得混合溶液为中性,则a∶b=________,生成沉淀的物质的量为________ mol.
(2)若a∶b=9∶2,则所得溶液pH=________,该混合溶液最多能够溶解铁粉________g(最终结果用含a、b的表达式来表示).
解析:Ⅰ.(1)中Al3+与HCO发生水解相互促进的反应.(2)应从Na2CO3与NaHCO3产生CO2多少及生成CO2的快慢进行分析.(3)Al3+水解使溶液呈酸性,H+能腐蚀铁但不能腐蚀玻璃.
Ⅱ.pH=11的Ba(OH)2溶液中c(OH-)=0.01 mol/L,当二者按9∶2体积比混合时,n(OH-)<n(H+),酸过量,剩余c(H+)=(0.2-0.09)÷(9+2)=0.01(mol/L),即pH=2,剩余的H+与Fe按物质的量之比为2∶1的比例反应.
答案:Ⅰ.(1)Al3++3HCO===Al(OH)3↓+3CO2↑
(2)不合理 Al3+的物质的量一定时,用与NaHCO3等物质的量的Na2CO3与Al3+作用放出的CO2少且速率慢,不利于灭火
(3)不妥当 Al2(SO4)3水解呈酸性,会腐蚀铁桶;Al2(SO4)3和NaHCO3反应生成的Al(OH)3会覆盖在固体表面,阻碍反应的继续进行
Ⅱ.(1)10 0.05b或0.005a (2)2 0.28(a+b)
12.(10分)如图所示三个烧瓶中分别装入含酚酞的0.01 mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
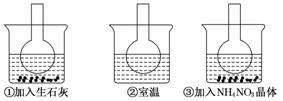
(1)含酚酞的0.01 mol/L CH3COONa溶液显浅红色,其原因为____________________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________.
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向烧瓶②中加入少量下列物质,写出水解平衡移动的方向
|
加入的物质 |
平衡移动的方向 |
|
盐酸 |
|
|
Na2CO3固体 |
|
|
FeSO4固体 |
|
|
H2O |
|
解析:(1)CH3COONa溶液中因CH3COO-水解而使溶液呈碱性,故能使酚酞试液变红色.
(2)NH4NO3溶于水吸收热量,溶液红色变浅,说明溶液中c(OH-)减小,即降低温度能抑制CH3COO-的水解,因此水解反应为吸热反应.
(3)加水稀释,加盐酸和FeSO4固体均能促进CH3COO-的水解,而加入Na2CO3能抑制CH3COO-的水解.
答案:(1)CH3COO-+H2O CH3COOH+OH-,使溶液显碱性
CH3COOH+OH-,使溶液显碱性
(2)BD (3)右 左 右 右
11.(10分)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)______.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH浓度由大到小的顺序是(填序号)_______________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小顺序为____________________.
解析:(1)H2SO4、CH3COOH、NaOH抑制H2O的电离,NH4Cl促进水的电离,所以NH4Cl溶液中H2O电离出的H+的浓度最大,因H2SO4电离出的H+的浓度大,抑制水电离的能力最强,故H2SO4溶液中由H2O电离出的H+的浓度最小.而NaOH抑制H2O电离的能力比CH3COOH强,故由水电离出的H+的浓度大小顺序为:NH4Cl>CH3COOH>NaOH>H2SO4.
(2)在等物质的量浓度的NH4Cl、CH3COONH4、(NH4)2SO4、NH4HSO4、NH3·H2O中,由于NH的水解程度和NH3·H2O的电离程度都是微弱的,故(NH4)2SO4溶液中NH浓度最大,NH3·H2O中NH浓度最小.因CH3COONH4溶液中,CH3COO-的水解对NH的水解具有促进作用,故CH3COONH4溶液中NH浓度小于NH4Cl、NH4HSO4溶液中的NH浓度,又因HSO电离产生的H+抑制了NH的水解,故NH4HSO4溶液中NH浓度大于NH4Cl溶液中的NH浓度,综合上述,NH浓度由大到小的顺序为:(NH4)2SO4>NH4HSO4>NH4Cl>CH3COONH4>NH3·H2O.
(3)等物质的量的NaOH、NH4Cl反应后,生成等物质的量的NH3·H2O和NaCl.由于NaCl是强电解质,全部电离,NH3·H2O是弱电解质,部分电离产生NH和OH-,又由于H2O的电离导致溶液中c(OH-)>c(NH),故有:c(Na+)=c(Cl-)>c(OH-)>c(NH)>c(H+).
答案:(1)④②③① (2)⑥⑦④⑤⑧
(3)c(Na+)=c(Cl-)>c(OH-)>c(NH)>c(H+)
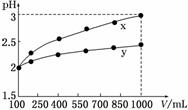
10.(2010·重庆高考)pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
解析:由图象可知x稀释10倍,pH变化1个单位(从pH=2变化为pH=3),故x为强酸,而y稀释10倍,pH变化小于1个单位,故y为弱酸,排除选项B、D;pH都为2的x、y,前者浓度为0.01 mol/L,而后者大于0.01 mol/L,故中和至溶液为中性时,后者消耗碱的体积大,故选项C正确.
答案:C
9.(2010·全国卷Ⅰ)下列叙述正确的是( )
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8 mol/L盐酸的pH=8.0
D.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
解析:醋酸在稀释时,其电离程度增大,n(H+)增大,但c(H+)减小,因此pH增大,故a<b,A项错误;在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液显弱碱性,B项错误;pH=8.0的溶液为碱性溶液,因此1.0×10-8 mol/L的盐酸其pH不可能等于8,只能接近7,C项错误;设NaOH溶液的pH=b,两溶液混合后溶液的pH=7,则1×10-3 L×10-1 mol/L=100×10-3 L×10b-14 mol/L,解得b=11,D项正确.
答案:D
8.(2010·长春模拟)将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是( )
A.b>a=d>c B.a=b>c>d
C.a=b>d>c D.c>a=d>b
解析:pH=3的盐酸中c(H+)=1×10-3 mol·L-1,与c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液混合,混合液呈中性时二者的体积相等,即a=d;NH3·H2O为弱电解质,1×10-3 mol·L-1的氨水中c(OH-)<1×10-3 mol·L-1,因此1×10-3 mol·L-1的氨水和c(OH-)=1×10-3 mol·L-1的氨水分别与盐酸混合,混合液呈中性时,b>c.
答案:A
7.(2010·厦门模拟)某研究小组为测定食用白醋中醋酸的含量进行了如下操作,其中正确的是( )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4.0 g NaOH到1 000 mL容量瓶加水至刻度,配成1.00 mol·L-1 NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
解析:白醋呈酸性,应该用酸式滴定管量取,A项错,配制溶液的方法不正确,B项错;滴定过程中眼睛应该注视锥形瓶中溶液颜色的变化,D项错.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com