
题目列表(包括答案和解析)
1.反应2A(g)+B(g)  2C(g);ΔH>0,下列反应条件有利于生成C的是( )
2C(g);ΔH>0,下列反应条件有利于生成C的是( )
A.低温、低压 B.低温、高压
C.高温、高压 D.高温、低压
解析:2A(g)+B(g)  2C(g);ΔH>0,正反应为气体体积减小的吸热反应,升高温度、增大压强均可使化学平衡向正反应方向移动,有利于生成C.
2C(g);ΔH>0,正反应为气体体积减小的吸热反应,升高温度、增大压强均可使化学平衡向正反应方向移动,有利于生成C.
答案:C
5.(2010·上海高考)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)  2SO3(g),ΔH=-190 kJ/mol
2SO3(g),ΔH=-190 kJ/mol
(1)下列描述中能说明上述反应已达平衡的是________.
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(2)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=________ mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______ mol.
解析:(1)该反应是反应前后气体物质的量不相等的反应,故密闭容器中气体的分子数保持不变,气体的物质的量(即气体的平均分子量)不再发生变化时,表明反应已处于平衡状态.
(2)v(SO3)==0.072 mol/(L·min)
v(O2)=v(SO3)=0.036 mol/(L·min)
第一次平衡时:2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
起始: 0.2 mol 0.10 mol 0
变化: 0.18 mol 0.09 mol 0.18 mol
平衡: 0.02 mol 0.01 mol 0. 18
mol
18
mol
再往容器中充入0.2 mol SO2和0.1 mol.若保持恒压,则可建立等效平衡,此时n(SO3)=0.18 mol×2=0.36 mol现保持恒温恒容,则需要将气体增压,上述平衡正向移动,n(SO3)>0.36 mol.
答案:(1)bd (2)0.036 向正反应方向 0.36 0.40
[发展等级评价]
(限时45分钟,满分100分)
4.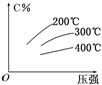 (2010·湘潭模拟)可逆反应mA(s)+nB(g)
(2010·湘潭模拟)可逆反应mA(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述正确的是( )
eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述正确的是( )
A.达平衡后,若升温,平衡右移
B.化学方程式中m+n>e+f
C. 达平衡后,加入催化剂则C%增大
达平衡后,加入催化剂则C%增大
D.达平衡后,增加A的量有利于平衡向右移动
解析:由图象可知,同一温度下随着压强的增大,C的百分含量增大,平衡向右移 动,故n>e+f,则m+n>e+f,B正确;同一压强下,温度越低,C的百分含量越大,则升温,平衡左移,A错误;达平衡后,加入催化剂,平衡不移动,则C%不变,C错误;A是固体,增加A的量平衡不移动,D错误.
动,故n>e+f,则m+n>e+f,B正确;同一压强下,温度越低,C的百分含量越大,则升温,平衡左移,A错误;达平衡后,加入催化剂,平衡不移动,则C%不变,C错误;A是固体,增加A的量平衡不移动,D错误.
答案:B
3.(2010·安徽高考,有改动)低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
ΔH<0
在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使化学平衡向正反应方向移动
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
解析:该反应是气体体积增大的放热反应,A项升高温度,平衡逆向移动 ,不正确;B项,增大NH3的浓度,平衡向右移动,使氮氧化物的转化率增大,不正确;C项NO,N2的消耗分别代表正反应和逆反应,正确;D项,催化剂不影响化学平衡的移动,不正确.
答案:C
2. (2010·唐山模拟)右图中曲线a表示放热反应X(g)+Y(g)
(2010·唐山模拟)右图中曲线a表示放热反应X(g)+Y(g)
 Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
A .升高温度 B.加大X的投入量
.升高温度 B.加大X的投入量
C.使用催化剂 D.缩小体积
解析:升高温度,X的转化率降低,A不可取;加大X的投入量,则X的转化率降低,B不可取;使用催化剂可以提高反应速率,但平衡不移动,A的转化率不变,C措施可取;缩小体积,平衡向正反应方向移动,X的转化率提高,D措施不可取.
答案:C

[基础等级评价]
1.(2010·海南高考)对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
解析:速率之比等于方程式的计量系数之比,A项,v(W)=v(Z);B项,3v(X)=2v(Z);C项,2v(X)=v(Y);D项,2v(W)=3v(X).
答案:C
6.常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O.
(1)上述溶液中,可发生水解的是________(填序号,下同).
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为________________________________________________________________________.
(3)向④中加入少量氯化铵固体,此时的值________(填“增大”、“减小”或“不变”).
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________________________________________________________________.
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________.
解析:(3)因④中存在NH3·H2O NH+OH-,加入NH4Cl后导致c(NH)增大,c(OH-)减小,故c(NH)/c(OH-)的值增大.
NH+OH-,加入NH4Cl后导致c(NH)增大,c(OH-)减小,故c(NH)/c(OH-)的值增大.
(4)若盐酸与氨水等体积混合,溶液恰好完全反应,溶液呈酸性,现在溶液呈中性,故盐酸体积小于氨水体积,由电荷守恒原理知此时c(NH)=c(Cl-)但比c(OH-)大.
(5)稀释后c(HCl)=0.01 mol/L,则c(OH-)=10-12 mol/L.故由水电离出的c(H+)=10-12 mol/L.
答案:(1)①② (2)c(Na+)>c(HCO)>c(OH-)>c(H+)>c(CO) (3)增大 (4)小于 c(NH)=c(Cl-)>c(H+)=c(OH-) (5)10-12 mol/L
5.(2010·东城模拟)下列关于电解质溶液的叙述正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
解析:选项A,Na2CO3的水解能力大于NaHCO3的水解能力,常温下,同浓度的Na2CO3溶液的pH大于NaHCO3溶液的pH.选项B,根据电荷守恒可得:c(NH)+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(NH)=c(Cl-),故有:c(NH)=c(Cl-)>c(H+)=c(OH-).选项C,pH相同的HCl、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和相同体积、相同pH的HCl、CH3COOH溶液时,CH3COOH消耗NaOH溶液的物质的量多.选项D,稀释HCl溶液时,c(H+)下降,但c(OH-)上升.
答案:A
4.(2010·江苏高考)常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图所示.下列说法正确的是( )
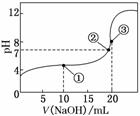
A.点①所示溶液中:
c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:
c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
解析:本题考查溶液中的电荷守恒、物料守恒和质子守恒等关系,意在考查考生灵活运用上述三个守恒关系的能力.A项,根据电荷守恒关系有:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),此时溶液中的c(CH3COOH)与c(Na+)不相等,故不正确;B项,点②溶液呈中性,所加入的氢氧化钠溶液的体积小于20 mL,此时根据物料守恒可知c(Na+)<c(CH3COO-)+c(CH3COOH),故不正确;C项,点③溶液中两者恰好完全反应,溶液中各离子浓度关系应为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故不正确;D项,当刚加入少量氢氧化钠溶液时可能会出现题中情况,故正确.
答案:D
3.(2010·石家庄模拟)现有常温下pH=3的醋酸和pH=3的硫酸两种溶液,下列叙述中正确的是( )
A.两溶液中水电离出的c(H+)均为1×10-11 mol/L
B.加水稀释100倍后两溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相同
D.等体积的两溶液中分别加入足量锌片时放出H2的体积相同
解析:加水稀释后硫酸的pH变化较大,醋酸的pH变化较小,B项错误;H2SO4为二元强酸,醋酸为一元弱酸,pH均等于3的醋酸和硫酸中c(CH3COO-)>c(SO),C项错误;等体积等pH的醋酸和硫酸两溶液中加入足量锌片,醋酸产生的H2多,D错误.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com