
题目列表(包括答案和解析)
11.(8分)(2010·山东高考,有改动)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应:2HI(g)  H2(g)+I2(g),H2物质的量随时间的变化如图所示.
H2(g)+I2(g),H2物质的量随时间的变化如图所示.
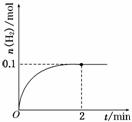
0-2 min内的平均反应速率v(HI)=________.
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍.
a.HI的平衡浓度 b.达到平衡的时间
c.平衡时H2的体积分数
解析:从图中可知:
v(H2)==0.05 mol/(L·min)
v(HI)=2v(H2)=0.05 mol/(L·min)×2=0.1 mol/(L·min)
HI(g)的分解反应是一个气体体积不变的反应,故改变条件后的平衡与原平衡等效,故a正确,c错误,HI的浓度是原来的2倍,由于浓度增大,反应速率加快,达到平衡所需时间缩短,b错误.
答案:0.1 mol/(L·min) a
10.(2010·四川高考)反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
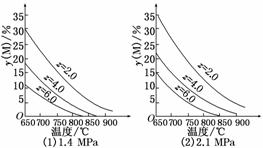
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数增加
解析:本题考查的知识点是化学平衡的移动,意在考查考生的分析判断能力.可逆反应中,催化剂只能改变化学反应速率,A错;由两个图象可知,M的体积分数随着温度升高而降低,即温度升高,平衡右移,故平衡时生成物Q的体积分数增加,B正确;同为650℃、z=2.0,压强为1.4 MPa时,y(M)=30%,而压强为2.1 MPa时,y(M)=35%,即增大压强,平衡左移,故平衡时Q的体积分数减小,C错;由图象可知,同温、同压时,若N的物质的量增加,而M的物质 的量不变,则尽管z越大,y(M)减小,平衡右移,但Q增加的物质的量远小于加入的N的物质的量,此时Q的体积分数减小,D错.
的量不变,则尽管z越大,y(M)减小,平衡右移,但Q增加的物质的量远小于加入的N的物质的量,此时Q的体积分数减小,D错.
答案:B
9.在一个容积为V L的密闭容器中,放入2 L
A(g)和1 L B(g),在一定条件下发生下列反应:3A(g)+B(g)  nC(g)+2D(g).达到平衡后,A物质的量浓度减小,混合气的平均摩尔质量增大,则该反应的化学方程式中n的值是( )
nC(g)+2D(g).达到平衡后,A物质的量浓度减小,混合气的平均摩尔质量增大,则该反应的化学方程式中n的值是( )
A.1 B.2
C. 3 D.4
3 D.4
解析:混合气的平均摩尔质量=,在密闭容器中,气体的质量不变,混合气体的平均摩尔质量增大,则n总减小,即n+2<3+1,n<2,则n=1.
答案:A
8.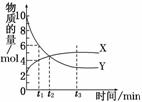 (2010·蚌埠模拟)一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如右图.下列叙述中正确的是( )
(2010·蚌埠模拟)一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如右图.下列叙述中正确的是( )
A.反应的化学方程式为5Y X
X
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
解析:反应开始时Y为10 mol,X为2 mol,达到平衡时Y减少了7 mol,X增多了3 mol,因此反应方程式是7Y 3X,A不正确;t1时,Y为6 mol、X为4 mol,其物质的量比为3∶2,即Y的浓度是X浓度的1.5倍,B正确.从图象可以看出,t2时刻X、Y两物质的物质的量相等,而不是反应速率相等,C不正确;t3时,反应达到平衡状态,所以正反应速率等于逆反应速率,D不正确.
3X,A不正确;t1时,Y为6 mol、X为4 mol,其物质的量比为3∶2,即Y的浓度是X浓度的1.5倍,B正确.从图象可以看出,t2时刻X、Y两物质的物质的量相等,而不是反应速率相等,C不正确;t3时,反应达到平衡状态,所以正反应速率等于逆反应速率,D不正确.
答案:B
7.可逆反应aA(g)+bB(g)  cC(g)+dD(s) ΔH=Q kJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示.据图分析,以下说法正确的是( )
cC(g)+dD(s) ΔH=Q kJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示.据图分析,以下说法正确的是( )
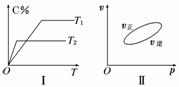
A.T1<T2,Q>0
B.增大压强,B的转化率减小
C.当反应达到平衡时,混合气体的密度不再变 化
化
D.a+b>c+d
解析:A项,根据图象Ⅰ,T2时达到平衡所需时间短,故温度:T2>T1,从T1到T2,升温,C%降低,表明升高温度,平衡向逆反应方向移动,则正反应为放热反应,Q<0,故不正确;B项,由图象Ⅱ可知,增大压强,v正>v逆,平衡向正反应方向移动,则B的转化率增大,故不正确;由上述可知,a+b>c,D物质是固体,故不能确定a+b是否大于c+d,不正确.
答案:C
6.已知:H2(g)+I2(g)  2HI(g);ΔH<0.有相同容积的定容密闭容器甲和
2HI(g);ΔH<0.有相同容积的定容密闭容器甲和 乙,甲中加入H2和I2(g)各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
乙,甲中加入H2和I2(g)各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度
B.甲中加入 0.1
mol He,乙不变
0.1
mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
解析:相同温度下,甲、乙两容器达到的平衡状态相同,c(HI)相同;若甲中降低温度,上述平衡正移,c(HI)增大.
答案:C
5.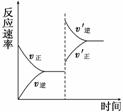 (2010·石家庄模拟)一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)
(2010·石家庄模拟)一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)  pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A.正反应是吸热反应
B.逆反应是放热反应
C.m+n<p+q
D.m+n>p+q
解析:A项,升高温度,由图象判断平衡向逆反应方向移动,则正反应为放热反应,故不正确;B项,由A项判断,逆反应应该是吸热反应,不正确;C项,增大压强,由图象判断平衡向逆反应方向移动,即逆反应方向是气体体积减小的方向,正确;D项,不正确.
答案:C
4.符合图1、图2的反应是( )
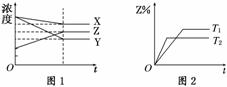
A.X(g)+3Y(g)
 2Z(g);ΔH>0
2Z(g);ΔH>0
B.X(g)+3Y(g)
 2Z(g);ΔH<0
2Z(g);ΔH<0
C.X(g)+2Y(g)
 3Z(g);ΔH<0
3Z(g);ΔH<0
D.5X(g)+3Y(g)  4Z(g);ΔH<0
4Z(g);ΔH<0
解析:由图1中X、Y、Z浓度的改变量可得反应的化学方程式为X+3Y 2Z,结合图2知T2>T1(T2先到达平衡),又因平衡时Z%随着温度升高而降低,所以正反应为放热反应,ΔH<0,故B选项正确.
2Z,结合图2知T2>T1(T2先到达平衡),又因平衡时Z%随着温度升高而降低,所以正反应为放热反应,ΔH<0,故B选项正确.
答案:B
3.反应A(g)+3B(g)
 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
A.v(D)=0.4 mol/(L·s)
B.v(C)=0.5 mol/(L·s)
C.v(B)=0.6 mol/(L·s)
D.v(A)=0.15 mol/(L·s)
解析:比较同一化学反应在不同情况下反应速率的快慢,应选用一种物质作标准,然后利用化学反应速率之比等于化学方程式中各物质的化学计量数之比,求出不同情况下用同一物质表示的化学反应速率,再进行比较可得:v(C)>v(D)=v(B)>v(A).
答案:B
2.在容器中充入SO2和只由18O原子组成的氧气(18O2),在一定条件下达到平衡时,18O存在于( )
A.只存在于O2中
B.只存在O2和SO3中
C.只存在于SO2和SO3中
D.SO3、SO2和O2中都有可能存在
解析:化学平衡是一动态平衡,18O从O2中进入平衡体系,由于v正、v逆的存在,使得SO3中含有18O,逆反应又会使18O从SO3中转移到SO2中.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com