
题目列表(包括答案和解析)
21.(11分)某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、C u2+、Cl-.该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益.
u2+、Cl-.该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益.
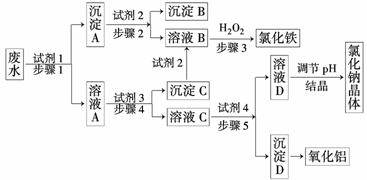
请填写出下列空白:
(1)图中试剂1是______________,试剂2是______________.
(2)步骤1和步骤2所用到的玻璃仪器是_________________________________________
_______ _________________________________________________________________.
_________________________________________________________________.
(3)步骤1反应的离子方程式为________________________________________________.
(4)步骤3反应的离子方程式为________________________________________________.
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式为________________
________________________________________________________________.
解析:所加试剂的关键是有效地将Na+、Al3+、Fe3+、Cu2+、Cl-分离并得到相应产品.利用这几种离子之间的性质差异,将它们分离开.若试剂1为足量的NaOH,沉淀A为Fe(OH)3和Cu(OH)2,根据高中知识和题目信息,无法实现Fe(OH)3和Cu(OH)2的分离;若试剂1为足量的废铁屑,Fe与Cu2+、Fe3+反应经过滤后得到含有Fe、Cu的沉淀A,向Fe、Cu混合物中加入足量的稀盐酸得到Cu和FeCl2,FeCl2再与H2O2反应得到FeCl3:2Fe2++H2O2+2H+===2Fe3++2H2O.溶液A中含有Na+、Al3+、Fe2+、Cl-,利用Al(OH)3的两性实现Fe2+、Al3+的分离,所以试剂3为过量的NaOH溶液,沉淀C为Fe(OH)2,其与盐酸反应生成FeCl2,再经步骤3可得FeCl3,溶液C为NaCl、NaOH、NaAlO2的混合液,向该溶液中通入过量的廉价CO2,可将AlO转化为Al(OH)3沉淀,将得到的Al(OH)3沉淀加热即得到Al2O3,所得溶液D中含有NaCl、NaHCO3,再用盐酸调节其pH得到NaCl溶液,NaCl溶液经蒸发、结晶得到NaCl晶体.
答案:(1)废铁屑 稀盐酸
(2)漏斗、玻璃棒、烧杯
(3)Fe+Cu2+===Cu+Fe2+,Fe+2Fe3+===3Fe2+
(4)2Fe2++H2O2+2H+===2Fe3++2H2O
(5)AlO+CO2+2H2O===Al(OH)3↓+HCO
20.(8分)近20年来,对氢能源的研究获得了巨大进步.氢能源是一种需要依靠其他能源如石油、煤、原子能等能量制取的“二级能源”,而存在于自然界的可以直接提供能量的能源称为一级能源,如煤、石油、太阳能等.
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是________.
A.电解水
B.锌和稀硫酸反应
C.光解海水
D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大.已知热化学方程式为:
H2(g)+1/2O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1
C(g)+O2(g)===CO2(g);ΔH=-393.5 kJ·mol-1
试通过计算说明等质量的 氢气和碳燃烧时产生的热量之比是________.
氢气和碳燃烧时产生的热量之比是________.
(3)氢能源可实现能源的贮存,也可实现经济、高效的输送.研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78.已知标准状况下,1 cm3的钯粉大约可吸附896 cm3的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式________________.
解析:(1)光解海水法:利用特殊催化剂,模拟生物光合作用制取氢气,是较经济且资源可持续利用的制氢方法.
(2)由热化学方程式可知,相同质量的氢气和碳完全燃烧时放出的热量之比为(285.8 kJ·mol-1×)∶(393.5 kJ·mol-1×)=4.36∶1.
(3)由题意可知,1 cm3钯粉可吸收896 cm3氢气,
n(Pd)∶n(H)=∶(×2)=1∶0.8,故钯的氢化物的化学式为PdH0.8.
答案:(1)C (2)4.36∶1 (3)PdH0.8
19.(8分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含________(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的 观点确实是正确的.
观点确实是正确的.
供选用的试剂:
a.酚酞试液 b.四氯化碳
c.无水酒精 d. 硫氰化钾溶液
硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现 象.(试剂填序号)
象.(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
解析:若Fe3+的氧化性大于Br2,则向FeCl2溶液中滴加溴水时,Br2不能把Fe2+氧化成Fe3+,故溶液的黄色是由单质溴引起的,只要用有机溶剂(如CCl4)萃取便可验证.
若Br2的氧化能力大于Fe3+,则向FeCl2溶液中滴加溴水时,Br2能将Fe2+氧化成Fe3+,故溶液中的黄色是由Fe3+引起的,用KSCN溶液检验溶液中是否存在Fe3+便可验证.
答案:(2)①Br2 ②Fe3+
(3)d 溶液呈红色 b CCl4层呈无色
18.(8分)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40-50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作____________(填“氧化剂”或“还原剂”).
(2)写出CuH在氯气中燃烧的化学反应方程式:_________________________________.
(3)CuH溶解在稀盐酸中生成的气体是__________(填化学式).
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_______________________________________________________.
解析:由CuSO4+“另一物质”―→CuH知,反应中铜元素价态降低,故“另一物质”是还原剂.CuH中铜、氢元素均处于低价态,与强氧化剂氯气反应时,均可被氧化而生成CuCl2、HCl.CuH溶于稀盐酸时,氢元素会发生价态归中型的氧化还原反应生成氢气.CuH与稀硝酸反应会被氧化成Cu2+与H+.
答案:(1)还原剂
(2)2CuH+3Cl22CuCl2+2HCl
(3)H2
(4)CuH+3H++NO===Cu2++2H2O+NO↑
17.(10分)甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)===2H2O(l);ΔH1=-571.8 kJ/mol;②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g);ΔH2=-192.9 kJ/mol.
(1)甲醇蒸气完全燃烧的热化学反应 方程式为_____________________________________
方程式为_____________________________________
________________________________________________________________________.
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol.
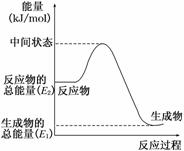
(3)H2(g)的燃烧热为__________________.
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:_________________________
________________________________________________________________________(写出两点即可).
解析:(1)根据盖斯定律,反应①+反应②有:2H2(g)+O2(g)+CH3OH(g)+1/2O2(g)===2H2O(l)+CO2(g)+2H2(g);ΔH=ΔH1+ΔH2=-571.8 kJ/mol-192.9 kJ/mol=-764.7 kJ/mol,则甲醇蒸气完全燃烧的热化学方程式为:CH 3OH(g)+3/2O2(g)===CO2(g)+2H2O(l);ΔH=-764.7 kJ/mol.
3OH(g)+3/2O2(g)===CO2(g)+2H2O(l);ΔH=-764.7 kJ/mol.
(2)反应的最终能量变化只与始态、终态能量有关,与中间状态无关,故ΔH2=E1-E2.
(3)根据燃烧热的定义可知,H2(g)的燃烧热为-285.9 kJ/mol.
(4)比较H2(g)和CH3OH(g)完全燃烧的热化学方程式,H2(g)燃烧产物为H2O,其对环境无任何影响,CH3OH(g)燃烧会产生对环境有影响的温室气体CO2,且等质量的H2(g)燃烧比CH3OH(g)燃烧放出的热量多.
答案:(1)CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l);ΔH=-764.7 kJ/mol
(2)E1-E2 (3)-285.9 kJ/mol
(4)H2燃烧的产物对环境无任何污染;等质量的H2完全燃烧放出的热量比CH3OH(g)的高(其他合理答案也可)
16.(2010·海南高考)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
D. mol·L-1
解析:n(MgSO4)=a mol
n(SO)=n(BaCl2)=b mol
n(K2SO4)=(b-a)mol
n(K+)=2n(K2SO4)=(2b-a)mol
c(K+)=== mol·L-1.
答案:D
15.某同学为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是 ( )
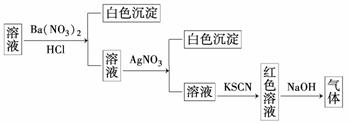
A.原溶液中一定含有SO离子
B.原溶液中一定含有NH离子
C.原溶液中一定含有Cl-离子
D.原溶液中一定含有Fe3+离子
解析:产生的气体能使湿润的红色石蕊试纸变蓝,一定是NH3,则溶液中一定有NH,由于加入Ba(NO3)2和HCl后能将SO氧化成SO,Fe2+氧化成Fe3+并引入了Cl-,所以不能确定原溶液中是否有SO、Cl-和Fe3+.
答案:B
14.(2010·石家庄模拟)下列图象表示Al3+与AlO物质的量变化的曲线,实线表示Al3+,虚线表示AlO,其中正确的是( )
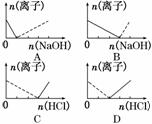
解析:根据反应Al3++3OH-===Al(OH)3↓和Al(OH)3+OH-===AlO+2H2O中消耗OH-的关系可知图象B正确;由AlO+H++H2O===Al(OH)3↓和Al(OH)3+3HCl===AlCl3+3H2O知C、D错误.
答案:B
13.(2010·临沂模拟)类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
|
选项 |
 已知 已知 |
类推 |
|
A |
将Fe加入CuSO4溶液中Fe+Cu2+=== Cu+Fe2+ |
将Na加入到CuSO4溶液 中2Na+Cu2+=== Cu+2Na+ 中2Na+Cu2+=== Cu+2Na+ |
|
B |
稀硫酸与Ba(OH)2溶液反应至中性2H++SO+Ba2++2OH-=== BaSO4↓+2H2O |
NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO+Ba2++2OH-=== BaSO4↓+2H2O |
|
C |
氯气与Ca(OH)2悬浊液反应Cl2+Ca(OH)2=== Ca2++Cl-+ClO-+H2O |
氯气与CaCO3悬浊液反应Cl2+CaCO3 ===Ca2++Cl-+ClO-+CO2↑ |
|
D |
向Ca(ClO)2溶液中通入少量CO2Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO |
向Ca(Cl O)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO O)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
解析:Na加入到CuSO4溶液中,Na先与水反应,A错误;Cl2先与水反应,生成的盐酸与Ca(OH)2和CaCO3都能反应,但次氯酸只能与Ca(OH)2反应,不与CaCO3反应,C错误;HClO能将CaSO3氧化,D错误.
答案:B
12.(2010·江西省重点中学协作体联考)下列过程都与热量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3  kJ/mol
kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
解析:稀H2SO4与稀Ba(OH)2溶液发生反应时,除生成H2O外,还生成BaSO4,其反应的ΔH<-57.3 kJ/mol.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com