
题目列表(包括答案和解析)
5.(2010·西城模拟)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是______________________________________________________.
(2)已知:C(s)+O2(g)===CO2(g);
ΔH=-437.3 kJ/mol
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ/mol
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ/mol
则煤的气化主要反应 的热化学方程式是:C(s)+H2O(g)===CO(g)+H2(g) ΔH=________
kJ/mol.
的热化学方程式是:C(s)+H2O(g)===CO(g)+H2(g) ΔH=________
kJ/mol.
 解析
解析 :(1)根据提供信息,1 mol甲烷完全燃烧生成液态水放出890.31 kJ的热量,因此其热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31
kJ/mol.
:(1)根据提供信息,1 mol甲烷完全燃烧生成液态水放出890.31 kJ的热量,因此其热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31
kJ/mol.
(2)设提供的三个反应分别为①、②、③,根据盖斯定律,由①-②-③得C(s)+H2O(g)===CO(g)+H2(g),因此该反应的ΔH=-437.3 kJ/mol-(-285.8 kJ/mol)-(-283.0 kJ/mol)=+131.5 kJ/mol.
答案:(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31 kJ/mol (2)+131.5
[发展等级评价]
(限时45分钟,满分100分)
4.(2010·石家庄模拟)已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ.则下列说法中正确的是( )
A.氢气的燃烧热为241.8 kJ/mol
B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量
C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6 kJ/mol
D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量
解析:A项,燃烧热是指生成液态水时放出的热量,而题中给出的是气态水,故不能得出燃烧热的数据;B项,气态水所具有的能量大于液态水所具有的能量;C项,氢气燃烧时放热,ΔH的值应为负值;D项,放热反应中,反应物的总能量大于生成物的总能量,故正确.
答案:D
3.(2010·潍坊模拟)将1 g H2和4 g O2混合点燃,充分反应,放出71.45 kJ热量,同样条件下1 mol H2在O2中完全燃烧放出的热量是( )
A.71.45 kJ B.142.9 kJ
C.571.6 kJ D.285.8 kJ
解析:1 g H2和4 g O2反应时,H2剩余,实际参加反应的H2为0.5 g,因此,1 mol H2在O2中完全燃烧放出的热量为71.45 kJ×4=285.8 kJ.
答案:D
2.(2010·广东高考)在298 K、100 kPa时,已知:
①2H2O(g)===O2(g)+2H2(g) ΔH1
②Cl2(g)+H2(g)===2HCl(g) ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
解析:根据盖斯定律:将①+②×2可得反应③
即ΔH1+2ΔH2=ΔH3
答案:A

[基础等级评价]
1.(2010·湘潭模拟)生活中到处都有化学知识,家用消毒柜常用臭氧(O3)消毒,已知在消毒过程中,通过放电发生如下反应:3O2(g)===2O3(g);ΔH=+144.8 kJ/mol.下列说法正确的是( )
A.O2和O3互为同分异构体
B.O2在任何条件下均能转化为O3
C.O2比O3稳定
D.为防止植物油等食物被细菌污染,可将其放入家用消毒柜消毒
解析:由热化学方程式可知,O3的能量高于O2,故O2比O3稳定;O2和O3互为同素异形体;植物油中含有碳碳双键,放在家用消毒柜中易被O3氧化而变质.
答案:C
5.从铁、盐酸、氧气、水、硝酸银溶液5种物质中选出1种或2种为反应物,按下列反应类型各写1个化学方程式.
(1)化合反应_______________________________________________________________.
(2)分解反应_______________________________________________________________.
(3)置换反应(有气体放出)__________ __________________________________________.
__________________________________________.
(4)复分解反应_____________________________________________________________.
解析:Fe与O2反应生成Fe3O4是化合反应;水分解生成H2和O2属于分解反应;Fe与盐酸的反应为置换反应;AgNO3与盐酸的反应属于复分解反应.
答案:(1)3Fe+2O2Fe3O4
(2)2H2O2H2↑+O2↑
(3)Fe+2HCl===FeCl2+H2↑
(4)AgNO3+HCl===AgCl↓+HNO3
4.某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2,取1.55 g该固体恰好与10 mL 4 mol/L硝酸完全反应,所得溶液仅为Mg(NO3)2溶液,则x值为( )
A.1 B.2
C.3 D.5
解析:由反应可知:HNO3所提供的NO都生成了Mg(NO3)2.n[Mg(NO3)2]=n(Mg2+)==0.02 mol,1.55 g该碱式盐的物质的量为 mol,故(24+24x+60x+34)=1.55,解得x=3.
答案:C
3.已知中学化学中常见反应形式为:A+B―→C+D+H2O,对于该反应的下列叙述不正确的是( )
A.该反应可能是氧化还原反应
B.该反应可能是非氧化还原反应
C.C和D中有一种一定是盐
D.A和B不一定是酸或碱
解析:如果是碳与浓HNO3反应,那么C、D都不是盐.
答案:C
2.(2010·济南模拟)分类是学习和研究化学的一种常用的科学方法.下列分类合理的是 ( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸和多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④根据反应的热效应将化学反应分为放热反应和吸热反应
⑤根据分散 系的稳定性大小将分散系分为胶体、溶液和浊液
系的稳定性大小将分散系分为胶体、溶液和浊液
A.只有②④ B.只有①③⑤
C.只有①②④ D.只有②③⑤
解析:酸分子中的氢原子不一定都能电离,如CH3COOH是一元酸,①错误;最外层电子数为1的元素可以是非金属元素H,也可以是碱金属元素,③错误;根据分散系中分散质微粒直径的大小可将分散系分为胶体、溶液和浊液,⑤错误.
答案:A
1.(2010·南昌模拟)图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
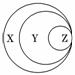
|
选项 |
X |
Y |
Z |
|
A |
胶体 |
混合物 |
淀粉溶液 |
|
B |
化合物 |
碱性氧化物 |
过氧化钠 |
|
C |
气态氢化物 |
化合物 |
甲 烷 烷 |
|
D |
强电解质 |
强酸 |
硫酸 |
解析:胶体是混合物中的一种,A错误;Na2O2不属于碱性氧化物,B错误;气态氢化物是化合物中的一种,C错误.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com