
题目列表(包括答案和解析)
10.(2010·重庆高考)已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
1
mol分子中的化学键 断裂时需要吸收的能量/Kj |
436 |
a |
369 |
则表中a为( )
A.404 B.260
C.230 D.200
解析:1 mol H2(g)与1 mol Br2(g)完全反应生成2 mol HBr(g)的ΔH1=-(369×2-436-a)=-(302-a) kJ/mol

则ΔH=ΔH2+ΔH1
即-72 kJ/mol=+30 kJ/mol+[-(302-a)kJ/mol]
=30 kJ/mol-302 kJ/mol+a
a=200
答案:D
9.(2010·西安模拟)氯原子对O3的分解有催化作用:O3+Cl===ClO+O2 ΔH1,ClO+O===Cl+O2 ΔH2,大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中正确的是( )
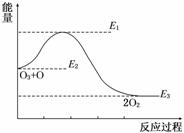
A.反应O3+O===2O2的ΔH=E1-E3
B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应
D.ΔH=ΔH1+ΔH2
解析:O3+O的总能量高于2O2的总能量,故反应O3+O===2CO2为放热反应,ΔH<0;此反应的ΔH=E3-E2,选项A、B、C均错误;根据题目的反应,结合盖斯定律可得ΔH=ΔH1+ΔH2.
答案:D
8.在298 K时,某密闭容器在催化剂存在时,进行合成氨反应,其热化学方程式为:N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ/mol,在该条件下,下列叙述正确的是( )
2NH3(g);ΔH=-92.4 kJ/mol,在该条件下,下列叙述正确的是( )
A.1 mol氮气和3 mol氢气反应放出热量为92.4 kJ
B.1 mol氮气和3 mol氢气反应吸收的 热量为92.4 kJ
热量为92.4 kJ
C.相同条件下,1 L氮气与3 L氢气的能量总和大于2 L氨气的能量
D.2 mol氨气分解吸收热量大于92.4 kJ
解析:合成氨反应为放热反应,选项B错误;可逆反应不能进行彻底,A、D项错误.
答案:C
7.(2010·邯郸模拟)一些烷烃的燃烧热如下表:
|
化合物 |
燃烧热(kJ/mol) |
化合物 |
燃烧热(kJ/mol) |
|
甲烷 |
890.3 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是( )
A.乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ/mol
2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ/mol
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3531.3 kJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
解析:选项A,所给的热化学方程式中H2O为非稳定的气态,且ΔH值也与化学计量数不符,错误.选项B,等物质的量的正丁烷燃烧释放出的热量大于异丁烷,说明正丁烷具有的总能量大于异丁烷,所以异丁烷的稳定性大于正丁烷.选项C,根据正丁烷的燃烧热大于异丁烷,推知正戊烷的燃烧热大于2-甲基丁烷的燃烧热,即大于3531.3 kJ/mol.选项D,相同质量的烷烃,氢的质量分数越大,燃烧放出的热量越多.
答案:C
6.强酸和强碱在稀溶液里反应的热化学方程式可表示为:
H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3 kJ/mol
已知:CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l);ΔH=-Q1 kJ/mol
HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l);ΔH=-Q2 kJ/mol
上述均系在溶液中进行的反应,Q1、Q2的关系正确的是( )
A.Q1=Q2=57.3 B.Q1>Q2>57.3
C.Q1<Q2=57.3 D.无法确定
解析:中和热表示的是强酸与强碱的稀溶液反应生成1 mol H2O(g)所释放出的热量,而第一个反应中CH3COOH为弱酸,电离时要吸热,所以反应放出的热量小于57.3 kJ,C项正确.
答案:C
5.(2010·陕西高考)已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ/mol;HCl(aq)与NaOH反应的ΔH=-55.6 kJ/mol.则HCN在水溶液电离的ΔH等于( )
A.-67.7 kJ/mol B.-43.5 kJ/mol
C.+43.5 kJ/mol D.+67.7 kJ/mol
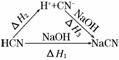 解析:根据盖斯定律,将HCN与NaOH的反应设计为以下两步:
解析:根据盖斯定律,将HCN与NaOH的反应设计为以下两步:
则ΔH1=ΔH2+ΔH3=-12.1 kJ/mol=ΔH2+(-55.6 kJ/mol)
ΔH2=+43.5 kJ/mol.
答案:C
4.已知反应:①101 kPa时,2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)===H2O(l);
ΔH=-57.3 kJ/mol
又知由H2和O2反应生成1 mol液态水比生成1 mol气态水多放出44 kJ热量.下列结论中正确的是( )
A.H2的燃烧热为285.8 kJ/mol
B.H2和O2反应生成液态水时的热化学方程式为H2(g)+O2(g)===H2O(l);
ΔH=-571.6 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
解析:燃烧热是指1 mol可燃物完全燃烧生成稳定氧化物时所放出的热量,故氢气的燃烧热为(483.6×+44.0) kJ/mol,即285.8 kJ/mol,A项正确;B项的热化学方程式应为H2(g)+O2(g)===H2O(l);ΔH=-285.8 kJ/mol,B项错误;中和热单位应为kJ/mol,故C错误;醋酸为弱酸,电离时要吸收热量,则最终放出的热量将小于57.3 kJ,D项错误.
答案:A
3.下列热化学方程式中ΔH的绝对值能表示可燃物燃烧热的是( )
A.CO(g)+O2(g)===CO2(g);
ΔH=-283.0 kJ/mol
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ/mol;
C.2H2(g)+O2(g)===2H2O(l);
ΔH=-571.6 kJ/mol
D.H2(g)+Cl2(g)===2HCl(g); ΔH=-184.6 kJ/mol
解析:燃烧热概念中的两个关键点是:①以1 mol可燃物为标 准,②产物为稳定的氧化物;B项H2O(g)相对H2O(l)不稳定;C项不以1 mol H2为标准;D项,没有生成稳定的氧化物.
准,②产物为稳定的氧化物;B项H2O(g)相对H2O(l)不稳定;C项不以1 mol H2为标准;D项,没有生成稳定的氧化物.
答案:A
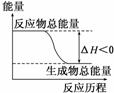
2.下列变化中一定为放热反应的是( )
A.N2(g)+O2(g)===2NO(g);ΔH=+182.6 kJ/mol
 B.H2O(g)===H2O(l);ΔH=-44.0 kJ/mol
B.H2O(g)===H2O(l);ΔH=-44.0 kJ/mol
C.形成化学键过程中放出256.6 kJ能量的化学反应
D.能量变化如图所示的化学反应
解析:ΔH为正值,说明该反应为吸热反应,A项错误;由水蒸气变为液态水,不属于化学反应,是物理变化,B项错误;化学反应过程中反应物的化学键断裂需吸收能量,题中仅知形成化学键过程中放出256.6 kJ能量,不一定为放热反应,C项错误;从图中可以看出,反应物的总能量高于生成物的总能量,为放热反应,D项正确.
答案:D
1.下列反应 中生成物总能量高于反应物总能量的是( )
中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
解析:生成物总能量高于反应物总能量的化学反应为吸热反应.B、C、D项为放热反应,A为吸热反应.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com