
题目列表(包括答案和解析)
2.能正确表示下列反应的离子方程式是( )
A.足量H2S气体通入Fe2(SO4)3溶液中:H2S+Fe3+===Fe2++S↓+2H+
B.足量铁与稀硝酸反应:Fe+4H++NO===Fe2++2H2O+NO↑
C.醋酸溶液与纯碱溶液:CO+2H+===CO2↑+H2O
D.等物质的量的Ba(OH)2与NaHSO4溶液反应:
Ba2++OH-+H++SO===BaSO4↓+H2O
解析:A项中电荷不守恒;B项中电荷不守恒;C项中CH3COOH为弱酸,应写化学式.
答案:D
1.下列各组离子,能在溶液中大量共存的是( )
A.Na+、Mg2+、AlO、Br-
B.H+、Fe2+、SO、NO
C.K+、NH、CO、OH-
D.Ca2+、Al3+、NO、Cl-
解析:A项,Mg2+水解呈酸性,AlO水解呈碱性,不能大量共存;B项,在酸性条件下Fe2+与NO不能共存;C项,NH能和OH-反应生成NH3和H2O,不能大量共存.
答案:D
14.(12分)(2010·北京高考)由短周期元素组成的化合物X是某抗酸药的有效成分.甲同学欲探究X的组成.查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝.
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液.
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5-6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是________.
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、________.
(3)Ⅲ中生成B的离子方程式是________________________________________________
______________________.
(4)Ⅳ中B溶解的离子方程式是________________________________________________.
(5)沉淀C的化学式是____________________.
(6)若上述n(A)∶n(B)∶n(C)=1∶1∶3,则X的化学式是________.
解析:向化合物X中加入过量盐酸,产生使澄清石灰水变浑浊的气体A,则A为CO2,同时得到无色溶液,则X中不含硅酸根离子,即X中不含硅元素,由实验Ⅱ判断X中不含钠元素,即X的有效成分不是NaHCO3.
由实验Ⅲ、Ⅳ判断X中含有Al3+,由实验V判断X中含有Mg2+,因此X的有效成分为碱式碳酸镁铝.
其中n(A)∶n(B)∶n(C)=n(CO)∶n(Al3+)∶n(Mg2+)=1∶1∶3
据电荷守恒判断溶液中含有OH-
且3n(Al3+)+2n(Mg2+)=n(OH-)+2n(CO)
则n(OH-)=3×1+2×3-2×1=7
X的化学式为Mg3Al(OH)7CO3.
答案:(1)CO2
(2)Na、Si
(3)Al3++3NH3·H2O===Al(OH)3↓+3NH
(4)Al(OH)3+OH-===AlO+2H2O
(5)Mg(OH)2
(6)Mg3Al(OH)7CO3

13.(12分)2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
|
阳离子 |
K+、Na+、Cu2+、Al3+ |
|
阴离子 |
SO、HCO、NO、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出B、D的化学式:B________、D________.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________.
(3)写出实验②发生反应的离子方程式_______________________________________
________________________________________________________________________.
(4)C常用作净水剂,用离子方程式表示其净水原理______________________________
________________________________________________________________________.
解析:根据实验①判断D中含有Cu2+;由实验②可知C中含有Al3+,E可能是NaOH或KOH,再依据实验③可知B、C中含有K+,故E为NaOH;根据实验④判断A中含有HCO,C、D中含有SO,故A为NaHCO3,D为CuSO4,而物质C中含有K+、Al3+和SO,则C为复盐KAl(SO4)2.
答案:(1)KNO3 CuSO4
(2)Na2CO3
(3)Al3++3OH-===Al(OH)3↓;Al(OH)3+OH-===AlO+2H2O
(4)Al3++3H2O===Al(OH)3(胶体)+3H+
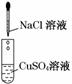
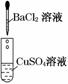
12.(14分)为了确认电解质溶液中部分离子相互间能否发生反应,做了如下三组实验
|
编 号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
实 验 |
 |
 |
 |
(1)实验Ⅰ的目的是_________________________________________________________.
(2)实验Ⅱ证明了________和________发生了化学反应,根据什么现象证明溶液中的另两种离子没有发生化学反应______________________________________________________.
(3)实验Ⅲ中的反应现象________________________________.反应的离子方程式为________________________________________________________________________.
解析:实验Ⅰ是实验Ⅱ和实验Ⅲ的对照实验,虽然实验Ⅰ中没有任何实验现象,其中没有发生化学反应,但有了这一实验可以帮助判断实验Ⅱ、实验Ⅲ中分别是哪几种离子发生了化学反应.设计实验Ⅰ的目的是证明溶液中Na+与SO、Cl-与Cu2+四种离子间不能发生反应.实验Ⅰ和实验Ⅱ联系起来就可判断,实验Ⅱ中是Ba2+跟SO之间发生反应生成硫酸钡沉淀.因为实验Ⅰ中证明Cl-、Cu2+间不发生反应,而且反应后溶液仍显蓝色,说明Cu2+仍存在于反应后的溶液中.所以实验Ⅱ的滤液中含有Cu2+、Cl-,往其中滴入硝酸银溶液后,产生白色沉淀,溶液仍显蓝色,说明实验Ⅲ中是Cl-和Ag+反应生成氯化银沉淀.
答案:(1)证明溶液中的Na+和SO、Cl-和Cu2+相互间不发生反应
(2)Ba2+ SO 过滤后得到的溶液呈蓝色
(3)产生白色沉淀,溶液呈蓝色
Ag++Cl-===AgCl↓
11.(12分)用一种试剂除去下列各物质中的杂质(括号内物质),写出所用试剂及离子方程式.
(1)BaCl2(HCl) 试剂________________,离子方程式:__________________________
______________________________________________.
(2)CO2(HCl) 试剂__________________,离子方程式:____________________________
____________________________________________.
(3)O2(CO2) 试剂____________________,离子方程式:___________________________
_____________________________________________.
(4)Fe(Al) 试剂______________________,离子方程式:___________________________
_____________________________________________.
解析:根据各物质的化学性质差异以及除杂的原则,选取合适的试剂来完成题目的要求.用适量Ba(OH)2溶液除去BaCl2中的盐酸.用饱和NaHCO3溶液除去CO2中的HCl,用NaOH溶液除去O2中的CO2,用NaOH溶液除去Fe中的Al.
答案:(1)Ba(OH)2溶液 H++OH-===H2O
(2)饱和NaHCO3溶液
H++HCO===H2O+CO2↑
(3)NaOH溶液 CO2+2OH-===CO+H2O
(4)NaOH溶液
2Al+2OH-+2H2O===2AlO+3H2↑
10.(2010·石家庄模拟)下列图象表示Al3+与AlO物质的量变化的曲线,实线表示
Al3+,虚线表示AlO,其中正确的是( )

解析:根据反应:Al3++3OH-===Al(OH)3↓和Al(OH)3+OH-===AlO+2H2O可知:生成Al(OH)3沉淀及沉淀溶解消耗OH-的物质的量之比为3∶1,故A错误,B正确;同理,根据反应:AlO+H++H2O===Al(OH)3↓,Al(OH)3+3H+===Al3++3H2O,判断C、D均错误.
答案:B
9.(2010·合肥模拟)某混合溶液中所含离子的浓度如下表,则Mn+及a值可能为( )
|
所含离子 |
NO |
SO |
H+ |
Na+ |
Mn+ |
|
浓度(mol/L) |
3 |
1 |
2 |
1 |
a |
A.Mg2+、1 B.Ba2+、0.5
C.Al3+、1.5 D.Fe2+、2
解析:溶液中存在电荷守恒:
c(H+)+c(Na+)+nc(Mn+)=c(NO)+2c(SO)
2+1+na=3+2×1
na=2
当n=3时,a=,(不合理)
n=2时,a=1,(合理).
答案:A
8.对于以下反应:
①KHCO3溶液与石灰水反应
②Na2SO3溶液与稀盐酸反应
③Si与烧碱溶液反应
④Fe与稀硝酸反应
改变反应物用量时,不能用同一个离子方程式表示的是( )
A.①②③ B.①②④
C.①③④ D.②③④
解析:①KHCO3过量时,离子反应为2HCO+Ca2++2OH-===CaCO3↓+CO+H2O,KHCO3少量时,离子反应为HCO+Ca2++OH-===CaCO3↓+H2O;②盐酸少量时,离子反应为SO+H+===HSO,盐酸过量时,离子反应为SO+2H+===H2O+SO2↑;③离子反应为Si+2OH-+H2O===SiO+2H2↑;④Fe少量时,离子反应为Fe+4H++NO===Fe3++NO↑+2H2O;Fe过量时,3Fe+8H++2NO===3Fe2++2NO↑+4H2O.
答案:B
7.(2010·陕西高考)下表中评价合理的是( )
|
选项 |
化学反应及其离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应: 2Fe3O4+18H+===6Fe3++H2↑+8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸: CO+2H+===CO2↑+H2O |
错误,碳酸镁不应写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO===BaSO4↓ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1∶2 |
解析:Fe3O4与稀HNO3反应不会产生H2,而是放出NO气体,A错误;(NH4)2SO4与Ba(OH)2反应时除产生BaSO4沉淀外,还生成NH3·H2O,C错误;选项D中的离子方程式书写正确.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com