
题目列表(包括答案和解析)
2.(2010·唐山模拟)下列说法中错误的是( )
A.原子晶体中只能存在非极性共价键
B.离子晶体在熔化状态下能导电
C.金属晶体通常具有导电、导热和良好的延展性
D.分子晶体的状态变化,只需克服分子间作用力
解析:SiO2属于原子晶体,其中Si-O键是极性共价键.
答案:A

[基础等级评价]
1.(2010·金丽衢十二校联考)下列各组给定原子序数的元素,能形成原子数之比为1∶1的原子晶体的是( )
A.6和14 B.6和8
C.7和12 D.11和17
解析:6号和14号元素分别为碳元素和硅元素,可形成SiC,属于原子晶体;6号和8号元素可形成CO和CO2,均属于分子晶体;7号和12号元素可形成Mg3N2,属于离子晶体;11号与和17号元素可形成NaCl,属于离子晶体.
答案:A
5.在肉制品加工中,使用发色剂--亚硝酸钠必须严格控制用量,确保使用安全.某一反应体系反应物和生成物共有六种物质:NaNO2、H2O、NO、I2、NaI、HI.已知该反应中NaNO2只发生了如下过程:NaNO2―→NO.
(1)该反应的氧化剂是________.
(2)该反应中,发生氧化反应的过程是__________________________________________.
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:_____________________
______________________________________________.
(4)若有0.25 mol的氧化剂被还原,则被氧化的还原剂为________mol.
(5)若误食NaNO2会导致血红蛋白中Fe2+转化为Fe3+而中毒.服用维生素C可以解除NaNO2的中毒.下列关于上述中毒、解毒过程的说法中,正确的是________.
A.NaNO2是还原剂
B.维生素C是还原剂
C.维生素C能把Fe2+氧化为Fe3+
D.NaNO2被氧化
解析:根据“NaNO2―→NO”可判断出“HI―→I2”,再由元素守恒可知NaI、H2O都在产物之中.NaNO2会将血红蛋白中Fe2+转化成Fe3+而中毒,维生素C可解除NaNO2中毒,说明维生素C能将NaNO2还原,即维生素C的还原性比较强.
答案:(1)NaNO2 (2)2HI―→I2
(3) 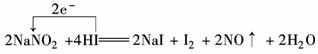
(4)0.25 (5)B
4.6.4 g铜与过量的硝酸(8 mol/L 60 mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中含有的H+为n mol.此时溶液中所含NO的物质的量为( )
A.0.28 mol B.0.31 mol
C.(n+0.2) mol D.(n+0.4) mol
解析:反应后溶液中的溶质为Cu(NO3)2和HNO3,故溶液中NO的物质的量为n mol+×2=(0.2+n) mol.
答案:C
3.(2010·郑州模拟)黄铜矿(CuFeS2)常用于提炼金属铜.黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为:2CuFeS2+O2+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
A.方框中的物质应为Cu2S
B.该反应的部分产物可用于硫酸工业
C.反应中SO2既是氧化产物又是还原产物
D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移
解析:从原子守恒角度分析知,方程式中所缺少的物质为Cu2S,再通过化合价的升降与得失电子守恒可以验证Cu2S是正确的;反应中有SO2生成,其可以用于制H2SO4;生成1 mol SO2时转移的电子为6 mol.
答案:D
2.(2010·福州模拟)有一种军用烟幕弹中装有ZnO、Al粉和C2Cl6,其发烟过程中的化学反应如下:
①3ZnO+2Al===Al2O3+3Zn
②3Zn+C2Cl6===3ZnCl2+2C
下列有关叙述不正确的是( )
A.两反应均属于置换反应
B.C2Cl6没有同分异构体
C.当原料恰好 完全反应时,
完全反应时, 两反应中转移的电子数相等
两反应中转移的电子数相等
D.当原料恰好完全反应时,两反应中还原剂的物质的量相等
解析:反应①中还原剂为Al,反应②中还原剂为Zn,两者物质的量之比应为2∶3.
答案:D
1.(2010·银川模拟 )某体系中存在如下反应:
)某体系中存在如下反应:
①H2S+4H2O-8e-―→SO+10H+、
②2IO+12H++10e-―→I2+6H2O.下列说法中正确的是( )
A.由上述反应可推知酸性:KIO3>H2SO4
B.由上述反应可推知氧化性:K2SO4>KIO3
C.若在①中失去0.2 mol电子,则②中可生成5.08 g I2
D.上述体系中当有0.5NA个电子转移时,消耗还原剂0.1 mol
解析:由于该反应是氧化还原反应而不是复分解反应,因此不能通过反应方程式推断酸性的强弱,A错误.反应中IO是氧化剂,SO是氧化产物,因此氧化性:KIO3>K2SO4,B错误.根据①,当有0.5 mol电子转移时,消耗还原剂H2S 0.0625 mol,D错误.
答案:C
14.(14分)(2010·上海高考)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
________+_______ _+________―→________+________
_+________―→________+________
(2)整个过程中的还原剂是________.
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________________.
解析:(1)KI溶液中加入少量氯水,I-被氧化成I2而使CCl4层呈紫色.继续加入氯水后,I2又会被氯水氧化成HIO3,而Cl2被还原成HCl.化学方程式为I2+5Cl2+6H2O===2HIO3+10HCl.
(2)由(1)中发生的化学反应判断KI和I2为该反应过程中的还原剂.
(3)由Cl2能将I2氧化成HIO3可知氧化性Cl2>HIO3,而Cl2不能将Br2氧化成HBrO3,故氧化性HBrO3>Cl2,即氧化性HBrO3>Cl2>HIO3.
答案:(1)I2+5Cl2+6H2O===2HIO3+10HCl
(2)KI、I2
(3)红棕 HBrO3>Cl2>HIO3

13.(12分)(2010·西安模拟)通过下列步骤可以测定金属锡样品的纯度:
①将试样溶于盐酸中,发生的反应为:Sn+2HCl===SnCl2+H2↑
②向①所得溶液中加入过量的FeCl3溶液,发生的反应为:SnCl2+2FeCl3===SnCl4+2FeCl2
③用已知浓度的K2Cr2O7溶液滴定生成的Fe2+,发生的反应(未配平)为:FeCl2+K2Cr2O7+HCl―→FeCl3+ KCl+CrCl3+H2O
KCl+CrCl3+H2O
请回答下列问题:
(1)氧化性:Fe3+________Sn4+(填“>”、“<”或“=”).
(2)③中配平后的化学方程式为:_______________________________________________
____________________.
(3)现有金属锡样品1.226 g,经上述各步反应后,共用去0.100 mol/L的K2Cr2O7溶液32.0 mL,则试样中锡的纯度为 .(假设杂质不参加反应)
解析:(1)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,结合②中反应,可以判断Fe3+的氧化性大于Sn4+的氧化性.
(2)根据得失电子守恒配平③中反应.
(3)根据①、②、③中反应,可得关系式Sn-SnCl2、SnCl2-2FeCl2,6FeCl2-K2Cr2O7,故总关系式为3Sn-K2Cr2O7,
设试样中含锡x mol,根据①②③可得关系式:
3Sn - K2Cr2O7
3 1
x mol 0. 100
mol/L×32.0×10-3L
100
mol/L×32.0×10-3L
=,x=9.6×10-3 mol
则试样中锡的纯度为:×100%=93.2%.
答案:(1)>
(2)6FeCl2+K2C r2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O
r2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O
(3)93.2%
12.(12分)(2010·北京高考)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验).
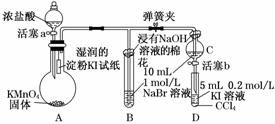
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐 酸.
酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是__________________________________________.
(2)验证氯气的氧化性强于碘的实验现象是_______________________.
(3)B中溶液发生反应的离子方程式是___________________________________________
________________________________________________________________________.
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________.
(5)过程Ⅲ实验的目的是________.
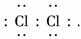 (6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________,得电子能力逐渐减
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________,得电子能力逐渐减 弱.
弱.
解析:(1)A中产生的黄绿色 气体为Cl2,其电子式为
气体为Cl2,其电子式为
(2)氯气遇湿润的淀粉KI试纸时,发生反应:Cl2+2KI===I2+2KCl,产生的I2遇淀粉变蓝,可以证明氯气的氧化性强于碘.
(3)B中Cl2与NaBr发生置换反应,离子方程式为:Cl2+2Br-===2Cl-+Br2.
(4)C中NaBr与氯气反应生成NaCl和Br2,将C中溶液滴入D中,振荡,发生反应:Br2+2KI===I2+2KBr,静置后D中液体分层,下层为碘的四氯化碳溶液,显紫红色,可以说明溴的氧化性强于碘.
(5)过程Ⅲ主要是为了确认C的黄色溶液中无Cl2,排除对溴置换碘实验的干扰.
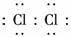 (6)氯、溴、碘单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱.
(6)氯、溴、碘单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱.
答案:(1)??
(2)淀粉KI试纸变蓝
(3)Cl2+2Br-===Br2+2Cl-
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静置后CCl4层溶液变为紫红色
(5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
(6)原子半径逐渐增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com