
题目列表(包括答案和解析)
7.下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )
A.Au B.CH4O
C.CaC2 D.SiO2
解析:金属单质不能表示一个分子;CaC2是离子化合物,不能表示一个分子;SiO2只表示其晶体中Si、O原子个数比,不表示一个分子.CH4O表示甲醇的分子式,可以表示甲醇的一个分子.
答案:B
6.下列反应过程中,同 时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl△NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
解析:A、B中无非极性共价键的断裂和形成,C中有非极性共价键(Cl-Cl)的断裂但无非极性共价键的形成.D中Na2O2既有离子键又有非极性共价键,CO2中有极性共价键,O2中有非极性共价键.
答案:D
5.下列有关化学键与晶体结构说法正确的是( )
A.两种 元素组成的分子中一定只有极性键
元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
解析:A项,如C2H6既有极性键又有非极性键,错误.B项,离子化合物的熔点也不一定都比共价化合物的熔点高,如SiO2的熔点比NaCl高,错误.C项,非金属元素组成的化合物也不一定都是共价化合物,如NH4Cl、NH4NO3都是离子化合物,错误.含有阴离子的化合物一定含有阳离子,D正确,但是含有阳离子的晶体不一定含有阴离子,如金属晶体.
答案:D
4.(2010·攀枝花模拟)下列叙述正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失 去电子的原子,易形成阴离子
去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.只有②⑦ B.只有①⑦
C.只有⑦ D.只有①⑤⑦
解析:H2O2、N2H4、C2H6等都含有非极性共价键,①错误;过氧化钠中含有非极性键,它是离子化合物,③错误;二氧化硅、碳化硅、氮化硅等都是原子晶体,也是共价化合物,它们的熔点高于离子晶体,④错误;稀有气体原子既难失去电子,又难得到电子,⑤错误;除稀有气体外,氮气、氧气、氯气、S8等单质都含非极性共价键,⑥错误.
答案:A
3.(2010·湖南九校联考)下列叙述中正确的是( )
A.干冰汽化时化学键发生断裂
B.SiO2晶体有多种晶型,其基本结构单元是[SiO4]四面体结构
C.Na2O和Na2O2所含化学键类型完全相同
D.Br2蒸气被木炭吸附时共价键被破坏
解析:A项,干冰汽化时只破坏分子间作用力,不涉及化学键的断裂,不正确;C项,过氧化钠中存在O-O共价键,而氧化钠中不存在共价键,不正确;D项,Br2蒸气被木炭吸附是物理变化,不存在共价键被破坏,不正确.
答案:B
2.下列各组化合物中,化学键类型相同的是( )
A.CaCl2和NaHS B.Na2O和Na2O2
C.CO2和CS2 D.HCl和NaOH
解析:CaCl2、Na2O只含有离子键,NaHS、Na2O2、NaOH既含有离子键又含有共价键,CO2、CS2、HCl中只含有共价键.
答案:C
1.下列物质中含离子键的是( )
A.Cl2 B.CO2
C.NaCl D.CH4
解析:Cl2是非金属单质,CO2、CH4是共价化合物,三者中均只含 共价键.
共价键.
答案:C
5.(2010·西城模拟)Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大.W、X与Y同周期,Y与Z同主族.Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子.Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比 2∶1反应形成盐丙.
2∶1反应形成盐丙.
(1)甲的电子式是________________.
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是____________.
(3)向少量丙溶液中加入浓Ba (OH)2溶液至过量并加热,反应的离子方程式是________________________________________________________________________.
(OH)2溶液至过量并加热,反应的离子方程式是________________________________________________________________________.
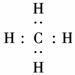 解析:短周期元素Q和W按照原子个数比4∶1形成10个电子的化合物,则Q为氢元素,W为碳元素;因W、X、Y同为第二周期,且Y与Z同主族,故Z为非金属元素,Z的最高价氧化物对应水化物为酸,Z能与乙(X的氢化物)发生反应生成盐,该氢化物一定为NH3,而该酸一定为二元酸,即Z为硫元素,Y为氧元素.
解析:短周期元素Q和W按照原子个数比4∶1形成10个电子的化合物,则Q为氢元素,W为碳元素;因W、X、Y同为第二周期,且Y与Z同主族,故Z为非金属元素,Z的最高价氧化物对应水化物为酸,Z能与乙(X的氢化物)发生反应生成盐,该氢化物一定为NH3,而该酸一定为二元酸,即Z为硫元素,Y为氧元素.
答案:(1) (2)H2O2
(3)2NH+SO+Ba2++2OH-BaSO4↓+2NH3↑+2H2O
[发展等级评价]
(限时45分钟,满分100分)
4.(2010·全国卷Ⅰ)下面关于SiO2晶体网状结构的叙述正确的是( )
A.最小的环上,有3个Si原子和3个O原子
B.最小的环上,Si和O原子数之比为1∶2
C.最小的环上,有6个Si原子和6个O原子
D.存在四面体结构单元,O处于中心,Si处于4个顶角
解析:本题考查晶体的结构,意在考查考生对常见晶体类型的空间结构的理解能力.二氧化硅晶体相当于将金刚石晶体中的C原子换成Si原子,同时在每两个Si原子中心连线上的中间加上一个O原子,最小的环上有12个原子(6个Si原子和6个O原子),A项错误,C项正确;最小的环上Si和O原子数之比为1∶1,B项错误;SiO2晶体为空间网状结构,每个Si原子与相邻的4个O原子以共价键相结合,前者位于四面体的中心,后者位于正四面体的4个顶点,D错.
答案:C
3.(2010·四川高考)下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
解析:He原子最外层电子数为2,元素周期表副族中某些元素原子最外层电子数也是2,A错;形成XY2型化合物的X、Y可以分别是ⅡA族和ⅦA族,如MgCl2,此时原子序数相差5,X、Y也可以分别是ⅣA族和ⅥA族,如CO2,此时原子序数相差2,B正确;由于HF分子间存在氢键,故氯化氢的沸点低于氟化氢的沸点,C错;CO2晶体是分子晶体,SiO2晶体是原子晶体,D错.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com