
题目列表(包括答案和解析)
3.(2010·黄冈模拟)下列物质中粒子间的作用既有非极性共价键,又有分子间作用力的是( )
 A.甲烷 B.金刚石
A.甲烷 B.金刚石
C.过氧化钠 D.白磷
解析:A项,CH4中只有C-H极性共价键,分子间有分子间作用力;B项,金刚石是原子晶体,无分子间作用力;C项,Na2O2是离子晶体,无分子间作用力;D项,白磷(P4)有非极性共价键和分子间作用力.
答案:D
2.(2010·湘潭模拟)几种短周期元素的原子半径及主要化合价见下表:
|
元素符号 |
K |
L |
M |
Q |
R |
T |
N |
|
原子半径/nm |
0.186 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
下列叙述正确的是( )
A.K、L、M三种元素单质的还原性逐渐增强
B.在RCl2分子中,各原子最外层均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中有共价键
解析:由元素的主要化合价结合原子半径知T是氧元素、Q是硫元素、K是钠元素、L是镁元素、M是铝元素、N是锂元素、R是铍元素.钠、镁、铝的还原性逐渐减弱,A项错;BeCl2中,铍最外层只有4个电子,B项错;SO3是非电解质,C项错;钠燃烧生成的Na2O2中,氧原子之间存在共价键.
答案:D
1.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
解析:A项中食盐为离子晶体,蔗糖为分子晶体;B项中钠为金属晶体,硫为分子晶体;C项,碘和干冰均属分子晶体,它们升华克服的是分子间作用力,属于同种类型;D项中SiO2为原子晶体,Na2O为离子晶体.
答案:C
14.(16分)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大.它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形 (V形)、直线形.回答下列问题:
(V形)、直线形.回答下列问题:
(1)Y的最高价氧化物的化学式为____________________________________________;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是________________;
(3)D和Y形成的化合物,其分子的空间构型为____________;
(4)D和X形成的化合物,其化学键类型属________,其晶体类型属________;
(5)金属镁和E的单质在高温下反应得到的产物是__________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________________________________;
(6)试比较D和X的最高价氧化物熔点的高低____________________________________.
解析:本题突破口在几种元素氢化物的构型,前20号元素中,氢化物构型为正四面体的为C、Si,三角锥形的为N、P,角形的为O、S,由原子序数依次增大得出D、E、X、Y、Z五种元素分别为C、N、Si、S、Cl.S的最高价为+6价,对应的氧化物为SO3;元素非金属性越强,最高价含氧酸酸性越强,所以能形成酸性最强的含氧酸的元素为Cl;CS2、CO2的空间构型均为直线形;C、Si形成以极性键构成的原子晶体.
答案:(1)SO3 (2)Cl
(3)直线形 (4)共价键 原子晶体
(5)Mg3N2
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
(6)SiO2的熔点高于CO2[来源:]

13.(14分)(2010·南昌模拟)W、Q、R、X、Y为短周期中的五种元素,已知W的低价氧化物分子与R单质分子的电子总数相等,相对分子质量也相等;Q与W同族,Q、X、Y同周期,X-、Y2-简单阴离子具有相同电子层结构.请回答:
(1)W原子的结构示意图为____________,其最高价氧化物的结构式为________________.
(2)W的最高价氧化物熔、沸点________(填“大于”、“小于”或“等于”)Q的最高价氧化物熔、沸点,主要原因是_____________________________________________________
________________________________________________________________________.
(3)Q与R形成的化合物是一种新型无机非金属材料,其化学式为_______ _,属于________晶体.
_,属于________晶体.
(4)1.2 g W单质在氧气中充分燃烧放出39.35 kJ的热量,写出此反应的热化学方程式:________________________________________________________________________
________________________________________________________________________.
解析:根据短周期元素中W的低价氧化物分子与R单质分子的电子总数以及相对分子质量均相等,可推测W为碳元素,R为氮元素;Q与W同主族,可以确定Q为硅元素;X、Y与Q同周期,且X-、Y2-的电子层结构相同,可以确定X是氯元素,Y是硫元素.
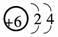 答案:(1)
O===C===O
答案:(1)
O===C===O
(2)小于 晶体类别不同,CO2属于分子晶体,SiO2属于原子晶体
(3)Si3N4 原子
(4)C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ/mol
12.(11分)A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,B和C的原子序数之和是A的原子序数的3倍,B和C形成的离子具有相同的电子层结构.试回答下列问题:
(1)三种元素的名称是:A______,B______,C______.
(2)由A和B形成的含有非极性键的离子化合物的电子式是______________________.
(3)B离子半径______(填“<”或“>”)C离子半径,B离子的氧化性比C离子的氧化性________(填“强”或“弱”),B和C元素最高价氧化物的水化物之间反应的离子方程式为___________________ _____________________________________________________.
_____________________________________________________.
(4)化合物X由元素A、B、C组成,写出X的溶液与过量盐酸反应的离子方程式________________________.
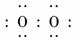 答案:(1)氧元素 钠元素 铝元素
答案:(1)氧元素 钠元素 铝元素
(2)Na+[ ?]2-Na+
(3)> 弱 Al(OH)3+OH-===AlO+2H2O
(4)AlO+4H+===Al3++2H2O
11.(9分)已知A、B、C、D、E、F均为短周期主族元素,原子序数依次增大,它们的原子半径和最高正化合价或最低负化合价如下表所示:
|
元素 |
A |
B |
C |
D |
E |
F |
|
原子半径(nm) |
0.152 |
0.077 |
0.071 |
0.186 |
0.110 |
0.102 |
最高正化合价或最低负 化合价 化合价 |
+1 |
+4 -4 |
-1 |
+1 |
+5 -3 |
+6 -2 |
(1)写元素符号:A________,D________,F________.
(2)A的单质可以在常温下与氮气反应,写出反应的化学方程式:___________________,产物的化学键类型为___________________.
(3)写出D与F形成的化合物水解的离子方程式:_________________________________.
解析:根据所有元素均为短周期元素,A、D均为+1价,A的半径小于D,但A的半径不是表格中最小的,故A为Li元素,D为Na元素,由F的化合价判断其为S元素;由B、E的化合价和半径推出B为C元素,E为P元素,最后根据化合价和半径推出C为F元素.
答案:(1)Li Na S
(2)6Li+N2===2Li3N 离子键
(3)S2-+H2O HS-+OH-
HS-+OH-
10.(2010·浙江高考)有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.
下列说法中,正确的是( )
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
解析:本题的突破口在Y上,短周期元素形成的单质中,熔点高、硬度大的半导体材料是硅,由此可推知X、Z、W、M分别是Na、S、Cl和O元素.A项钠元素和氧元素可形成Na2O和Na2O2两种化合物,不正确;B项因H2O分子间存在氢键,其相对分子质量最小,沸点却最高,不正确;C项,硅单质是原子晶体,硫单质和氯气是分子晶体,不正确;D项,氯气和臭氧都可以用作水处理中的消毒剂,正确.
答案:D
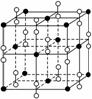
9.如图是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元).晶体中氧的化合价可看作是部分为0价,部分为-2价.钾、氧两元素所形成化合物的化学式是( )
A.K2O B.K2O2
C.K2O3 D.KO2
解析:根据K、O原子在晶胞中所处的位置,可知该晶体与NaCl晶体结构相似,不同之处是Cl-被O所代替,因此K、O两元素形成的化合物的化学式为KO2.
答案:D
8.下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CsCl CBr4 CF4
B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4
CF4
D.CF4 CBr4 CsCl SiO2
解析:先区分各选项中各物质的晶体类型,原子晶体的熔点>离子晶体的熔点>分子晶体的熔点.其中CBr4和CF4为分子晶体,它们的熔点高低取决于分子间作用力.
 答案:A
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com