
题目列表(包括答案和解析)
12.(12分)如图所示的实验装置可用来测定含两种元素的某种气体X的化学式.
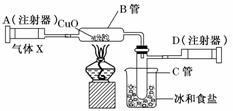
在注射器A中装有240 mL气体X,慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末.
在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气.试回答下列问题:
(1)X气体是由________和________元素组成的.
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g.根据实验时温度和压强计算1 mol X气体的体积是24000 mL,则X的摩尔质量是________g/mol.
(3)通过计算,确定X的化学式为________.
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应).
解析:在C管中收集到水,其中氧来源于CuO,则X中一定含有氢元素.在D中收集到N2,说明X中一定含有N元素,即X中含N、H两种元素.
B管中CuO含O:20.32 g-20.00 g=0.32 g,
n(O)==0.02 mol,故n(H)=0.02×2=0.04 mol.
n(N2)==0.01 mol,本实验条件下
Vm=24 L/mol,所以n(X)==0.01 mol,
因此n(X)∶n(N)∶n(H)=0.01 mol∶(0.01 mol×2)∶(0.02 mol×2)=1∶2∶4,X的化学式为N2H4,摩尔质量为32 g/mol.
答案:(1)N H (2)32 (3)N2H4
(4)N2H4+2CuON2+2H2O+2Cu
11.(8分)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O22O3.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________ g/mol(保留一位小数).
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________ L.
解析:(1)设原有O2 1 mol,由反应3O22O3知:
发生反应的O2为1 mol×30%=0.3 mol.
生成的O3为0.2 mol,故反应后所得气体为0.2 mol O3和(1-0.3)=0.7 mol O2.
故==35.6 g/mol
(2)3O22O3 ΔV
2 1
V(O3) (8-6.5)L
V(O3)=2×1.5 L=3 L.
答案:(1)35.6 (2)3
10.(2010·全国卷Ⅰ)一定条件下磷与干燥氯气反应,若0.25 g磷消耗掉314 mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( )
A.3∶1 B.5∶3
C.2∶3 D.1∶2
解析:参加反应的P和Cl2的物质的量之比为∶≈1∶1.74.
因此产物中n(P)∶n(Cl)=1∶(1.74×2)=1∶3.48
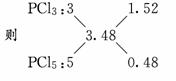
即产物中PCl3和PCl5的物质的量之比1.52∶0.48≈3∶1.
答案:A
9.(2010·上海高考)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol/L稀盐酸.下 列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是  ( )
( )

解析:n(NaOH)==0.01 mol
n(Na2CO3)==0.01 mol
向混合溶液中逐滴加入0.1 mol/L的盐酸,反应分为三个阶段
第一阶段:NaOH+HCl===NaCl+H2O,此阶段消耗盐酸0.1 L,无CO2气体放出.
第二阶段:Na2CO3+HCl===NaHCO3+NaCl,此阶段消耗盐酸0.1 L,无CO2气体放出.
第三阶段:NaHCO3+HCl===NaCl+H2O+CO2↑,此阶段消耗盐酸0.1 L,放出CO2 0.01 mol.
答案:C
8.(2010·海南高考)把V L含MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A. mol/L B. mol/L
C. mol/L D. mol/L
解析:根据反应:Mg2++2OH-===Mg(OH)2↓,
Ba2++SO===BaSO4↓
可知每一份溶液中:n(Mg2+)=n(OH-)=a mol,
n(SO)=n(Ba2+)=b mol
溶液中存在电荷守恒:2n(Mg2+)+n(K+)=2n(SO)
n(K+)=2n(SO)-2n(Mg2+)=2b-2×a=2b-a
则c(K+)== mol/L.
答案:D
7.(2010·江西师大附中模拟)在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子,则该硫酸盐的物质的量浓度为( )
A.1 mol/L B.2.5 mol/L
C.5 mol/L D.2 mol/L
解析:由硫酸盐溶液中含有1.5NA个硫酸根离子,同时含有NA个金属阳离子,可知金属离子与硫酸根离子物质的量之比为2∶3,故其化学式可表示为M2(SO4)3,则该硫酸盐的物质的量浓度为=2.5 mol/L.
答案:B
6.(2010·安徽高考)将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
解析:0.01 mol Na2O2、Na2O分别与100 mL水反应均生成0.02 mol NaOH,因忽略溶液体积的变化,则①、②中OH-的物质的量浓度相同,CO发生水解:CO+H2O HCO+OH-.使溶液中阴离子数目增多,故③中阴离子的浓度大于④中Cl-的浓度.
HCO+OH-.使溶液中阴离子数目增多,故③中阴离子的浓度大于④中Cl-的浓度.
答案:C
5.两份体积相同的某植物营养液,其配方如下:
  成分 成分含量 编号 |
KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
① |
0.3 mol |
0.2 mol |
0.1 mol |
- |
|
② |
0.1 mol |
0.3 mol |
- |
0.1 mol |
两种营养液的成分( )
A.n(K+)相同 B.n(Cl-)相同
C.完全相同 D.完全不同
解析:依题意,分别计算①和②中各种离子的物质的量:n(K+)=0.7 mol,n(SO)=0.3 mol,n(Zn2+)=0.1 mol,n(Cl -)=0.3 mol,故成分相同.
-)=0.3 mol,故成分相同.
答案:C
4.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
A.0.01 mol/L的蔗糖溶液
B.0.01 mol/L的CaCl2溶液
C.0.02 mol/L的NaCl溶液
D.0.02 mol/L的CH3COOH溶液
解析:“非挥发性溶质”的浓度越大,溶液的沸点就越高,其实质是比较溶质微粒的浓度大小.A项,蔗糖为非电解质,其微粒浓度为0.01 mol/L;B项,CaCl2为强电解质,完全电离,微粒浓度为0.03 mol/L;C项,NaCl为强电解质,完全电离,微粒浓度为0.04 mol/L;D项,CH3COOH为弱电解质,部分电离,微粒浓度大于0.02 mol/L而小于0.04 mol/L.
答案:C
3.(2010·东城模拟)已知Ca(OH)2的溶解度随温度升高而降低.将40℃的饱和澄清石灰水冷却至10℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是( )
A.溶液中Ca2+的数目
B.溶剂的质量
C.溶液中溶质的物质的量浓度
D.溶质的质量
解析:将40℃的饱和澄清石灰水冷却至10℃时,此 时溶液是不饱和溶液,溶液中溶质质量、溶剂质量均不变,所以溶液中Ca(OH)2的物质的量浓度不变.保持40℃向其中加入少量CaO,CaO与H2O反应导致溶剂质量减少,有部分Ca(OH)2晶体析出,但溶液仍是40℃的饱和溶液,Ca(OH)2的物质的量浓度不变.
时溶液是不饱和溶液,溶液中溶质质量、溶剂质量均不变,所以溶液中Ca(OH)2的物质的量浓度不变.保持40℃向其中加入少量CaO,CaO与H2O反应导致溶剂质量减少,有部分Ca(OH)2晶体析出,但溶液仍是40℃的饱和溶液,Ca(OH)2的物质的量浓度不变.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com