
题目列表(包括答案和解析)
0.(2)B (3)2V L/mol
(4)酸的浓度相同时,c(H+)不同 防止形成原电池,干扰实验现象的观察
5.某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气 体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
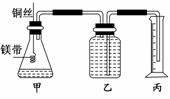
①配制浓度均为1 mol/L的盐酸和醋酸溶液;
②用________量取10.00 mL 1 mol/L的盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为_________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应__ ________,读出量筒中水的体积为V mL.
________,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法:
________________________________________________________________________
________________________________________________________________________.
(2)本实验中应选用________(填序号)的量筒.
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm=________.
(4)速率不等的原因是__________________________,铜丝不与酸接触的原因是__________________________________.
解析:②题中要求酸的体积10.00 mL较精确,应选酸式滴定管.
③Mg+2HCl(或HAc)===MgCl2+H2↑
24 g 2 mol 1 mol
a 1 mol/L×0.01 L n(H2)
a=0.12 g.
n(H2)=0.005 mol,应选200 mL量筒.
(3)Vm===0.2V L/mol.
答案:②酸式滴定管 ③0.12 ⑤反应起讫时间 ⑥将量筒缓缓向下移动,使乙、丙中液面相平
(1)两手掌紧贴锥形瓶外壁一段时间,如观察到广口瓶中长导管内有一段水柱高出液面,松开手后短导管内能形成一段倒吸的水柱,表明装置不漏气
4.相对分子质量为M的气态化合物V L(标准状况),溶于m g水中,得到质量分数为w%的溶液,物质的量浓度为c mol/L,密度为ρ g·cm-3,则下列说法正确的是( )
A.相对分子质量M=
B.物质的量浓度 c=
c=
C.溶液的质量分数w%=
D.溶液密度ρ=
解析:由c=知D错误;由公式c=知c==,B错误;由w%==知C错误,将此式变换后即可得到A项中的式子.
答案:A
3.向某HNO3和Fe(NO3)3的混合稀溶液中逐渐加入铁粉,产生无色气体,该气体遇到空气变为红棕色,溶液中Fe2+的浓度和加入Fe粉的物质的量之间的关系如图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )
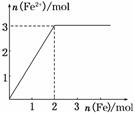
A.4∶1 B.3∶1
C.2∶1 D.1∶1
解析:混合溶液中加入铁粉发生的反应为:
3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
2Fe(NO3)3+Fe===3Fe(NO3)2
由图象可知加入Fe粉和生成Fe2+的物质的量之比为2∶3,设混合溶液中有x mol HNO3,y mol Fe(NO3)3,
则解得.
答案:A
2.在一定条件下,完全分解下列某化合物2 g,产生氧气1.6 g,此化合物是( )
A.1HO B.2HO
C.1HO D.2HO
解析:设H和O的质量数分别为x、y,则有:
=×2,解得=.
答案:B
1.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下,11.2 L氯气与足量钠充分反应转移电子数为NA
B.标准状况下,22.4 L氨气中氢原子数为3NA
C.由CO2和CO组成的混合物中共有NA个分子,其中的碳原子数为2NA
D.1 L浓度为1 mol·L-1的Na2CO3 溶液中含有NA个CO
溶液中含有NA个CO
解析:常温常压下,11.2 L Cl2的物质的量不足0.5 mol,故与足量Na反应转移的电子数小于NA;标准状况下,22.4 L NH3的物质的量为1 mol,含氢原子数为3NA;由CO2和CO组成的混合物中共有NA个分子,其中含有的碳原子数为NA;因CO水解,故1 L 1 mol·L-1的Na2CO3溶液中含有的CO数目小于NA.
答案:B
0.05 mol x y
则x=0.05×5=0.25 mol
V(O2)=0.25 mol×22.4 L/mol=5.6 L
y=0.05×2=0.1 mol
根据磷原子守恒可判断0.1 mol P2O5与水反应生成0.2 mol H3PO4
则c(H3PO4)==4.00 mol/L.
(2)n(H2O)==0.9 mol
由质量守恒可得生成难溶盐中含0.5 mol Ca、0.3 mol P、0.1 mol H和1.3 mol O.即难溶盐中N(Ca)∶N(P)∶N(H)∶N(O)=5∶3∶1∶13,其化学式为Ca5(PO4)3(OH).
(3)混合卤化磷中分子结构有3种的是PCl3Br2和PCl2Br3,其相对分子质量为297.5和342.
答案:(1)5.6 4.00
(2)Ca5(PO4)3(OH)
(3)297.5或342

14.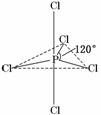 (16分)(2010·上海高考,有改动)白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构如右图所示.该结构中氯原子有两种不同位置.
(16分)(2010·上海高考,有改动)白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构如右图所示.该结构中氯原子有两种不同位置.
(1)6.20 g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为____________ L.
上述燃烧产物溶于水配成50.0 mL磷酸(H3PO4) 溶液,该磷酸溶液的物质的量浓度为________ mol/L.
溶液,该磷酸溶液的物质的量浓度为________ mol/L.
(2)含0.300 mol H3PO4的水溶液滴加到含0.500 mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g H2O.该难溶盐的化学式可表示为________.
(3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBrx(1≤x≤4,且x为整数).
如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为________.
解析:(1)n(P4)==0.05 mol
P4 + 5O2 2P2O5
1 mol 5 mol 2 mol
0.(2)4.0 (3)024 mol/L
13.(14分)(1)Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.现需配制250 mL 0.100 mol/L的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,还需要________.
(2)需准确称取Na2S2O3固体的质量为________ g.
(3)另取废水50.00 mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO全部转化为Cr2O;再加入过量KI溶液进行反应,然后在反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S 2O3溶液36.00 mL.已知有关反应的离子方程式为:①Cr2O+6I-+14H+===2Cr3++3I2+7H2O;②I2+2S2O===2I-+S4O.
2O3溶液36.00 mL.已知有关反应的离子方程式为:①Cr2O+6I-+14H+===2Cr3++3I2+7H2O;②I2+2S2O===2I-+S4O.
试计算该工厂废水中Ba2+的物质的量浓度.
解析:(1)要抓住“玻璃仪器”的字眼,因此还需要用来溶解固体的烧杯及用来定容的胶头滴管.
(2)Na2S2O3固体的质量为:0.100 mol/L×0.25 L×158 g/mol=3.95 g,但实验室所用的天平只能准确称量到0.1 g,故需准确称取Na2S2O3固体的质量为4.0 g.
(3)设Ba2+的物质的量为x,则根据相关反应可得以下关系式:
Ba2+-BaCrO4-1/2Cr2O-Cr3+-3/2I2-3S2O
1 3
x  0.036 L×0.100 mol/L
0.036 L×0.100 mol/L
解得:x=1.2×10-3 mol,
则c(Ba2+)==0.024 mol/L.
答案:(1)胶头滴管、烧杯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com