
题目列表(包括答案和解析)
20.(10分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质.某化学课外小组设计以下流程,以该矿样为原料生产CuCl2 · 2H2O 晶体.
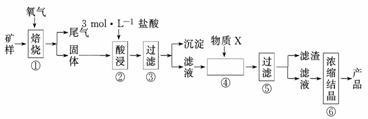
已知:在20 ℃ 时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH 见下表:
|
金属离子 |
开始形成氢氧化物沉淀的pH |
完全形成氢氧化物沉淀的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
回答下列问题:
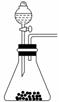 (l)步骤①的焙烧过程中需要通入氧气,在实验室中使用中学化学常见物质,按右图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式:
(l)步骤①的焙烧过程中需要通入氧气,在实验室中使用中学化学常见物质,按右图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式:
______________________________________________________________、
______________________________________________________________;
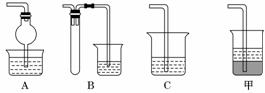
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物.若在实验室中以碱液吸收处理,下列A、B、C 装置中可行的是________(填字母);若选用甲装置,则烧杯中的下层液体可以是________________.
(3)步骤②酸浸过程中,需要用到3 mol·L-1的盐酸100 mL,配制该盐酸溶液时除了用到烧杯、玻璃棒、量筒外,还需要的仪器有________;
(4)步骤④加入物质X 的目的是________,物质X可以选用下列物质中的________.
A.氧化铜 B.稀盐酸
C.氨水 D.氧化亚铁
解析:(1)从题给制氧气装置图可知,该装置是液+固―→O2的装置,因此可用H2O2、MnO2或Na2O2和H2O制O2
(2)A、B可以防止倒吸, C不防倒吸.对于甲装置:SO2是极性分子,所以下层液体必须是非极性液体方可防止倒吸,CCl4比较合适.
C不防倒吸.对于甲装置:SO2是极性分子,所以下层液体必须是非极性液体方可防止倒吸,CCl4比较合适.
(4)由于第②步用3 mol·L-1的盐酸酸浸,要想使Fe3+沉淀,就调节pH,使之增大到[3.2,4.7)之间,即调节pH,又不引入杂质,CuO最好.
答案:(1)2H2O22H2O+O2↑
2Na2O2+2H2O===4NaOH+O2↑
(2)AB 四氯化碳
(3)100 mL 容量瓶、胶头滴管
(4) 调控溶液的pH ,使Fe3+以Fe(OH)3 沉淀的形式析出 A
19.(8分)某学习小组用下图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
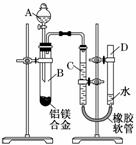
(1)A中试剂为_____________________________________________________________.
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是___________________________
________________________________________________________________________.
(3)需进行的操作有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.
上述操作的顺序是________(填序号);记录C的液面位置时,除视线平视外,还应________________________________________________________________________
________________________________________________________________________.
(4)B中发生反应的化学方程式为_____________________________________________.
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________________________.
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(“偏大”、“偏小”或“不受影响”).
解析:(1)Mg、Al均可与酸反应,因此不可以用酸来实验;Al可与碱溶液反应,Mg不与碱反应,可用NaOH与Al反应制取H2,然后用排水法收集,据此计算Al的百分含量.
(2)由于Mg、Al表面容易生成氧化膜,因而要用酸除去表面的氧化膜以防对实验造成影响.
(3)整个操作过程及原理是:检查装置的气密性;记录起始液面位置;加入碱液反应;不再产生气体时,记录最后液面位置,两次记录数据相减即为产生H2的体积;最后称得的固体即为Mg的质量.在读数时要注意D、C液面相平,否则会造成读数不准.
(4)B中发生的是Al与NaOH溶液的反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑.
(5)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量.而n(Al)可以由产生的H2获得.
(6)若未洗涤,则造成(a-c)变小,使测得的铝的质量分数偏小.
答案:(1)NaOH溶液
(2)除去铝镁合金表面的氧化膜
(3)⑤①④③② 使D和C的液面相平
(4)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(5)
(6)偏小
18.(8分)(2010·唐山模拟)教材中经常利用如图装置进行有关物质的制备和性质实验.
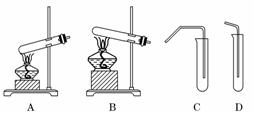
(1)请按要求填充下表空格:
|
实验名称 |
选用的仪器(填字母) |
C或D中所盛试剂(填名称) |
C或D中的现象 |
|
区别固体Na2CO3和NaHCO3 |
BD |
澄清石灰水 |
|
|
铜和浓硫酸反应 |
AC |
|
溶液红色褪去 |
|
制备乙酸乙酯 |
|
饱和碳酸钠溶液 |
上层有透明油状液体产生并有香味 |
(2)针对上述实验下列说法正确的是(填写字母代号)________.
A.Cu和浓硫酸反应时,可在装置C的试管口塞沾有碱液的棉花
B.加热装置C中已吸收Cu和浓硫酸反应生成物后的溶液不能出现红色
C.制备乙酸 乙酯时,装置C的导管末端在液面以下
乙酯时,装置C的导管末端在液面以下
D.装置B可用于制备氨气
解析:(1)碳酸氢钠受热分解产生二氧化碳,二氧化碳使澄清石灰水变浑浊;根据现象“溶液红色褪去”及铜与浓硫酸反应的产物可知加入的试剂为品红溶液;实验室中制 备乙酸乙酯的反应物为液体,所以选用装置A作为反应器,用装置C作为乙酸乙酯的接收装置及除杂装置.
备乙酸乙酯的反应物为液体,所以选用装置A作为反应器,用装置C作为乙酸乙酯的接收装置及除杂装置.
(2)铜与浓硫酸反应容易逸出有毒气体二氧化硫,该气体可以溶解在碱液中,所以可以用沾有碱液的棉花吸收,A正确;品红溶液吸收二氧化硫生成不稳定的无色物质,加热可以释放出二氧化硫,品红溶液恢复红色,B错误;为了防止倒吸,制备乙酸乙酯时,装置C的导管不能插入吸收液中,C错误;装置B是加热固体反应物的装置,可以制备氨气,D正确.
答案:(1)
|
|
|
|
|
|
|
|
|
澄清石灰水变浑浊 |
|
|
|
品红溶液 |
|
|
|
AC |
|
|
(2)AD
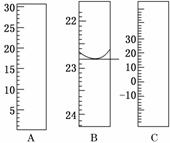
17.(8分)(2010·玉溪模拟)(1)下图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________.B的正确读数为________.
(2)下列实验操作、实验室事故处理正确的是________(填序号).
A.配制500 mL某物质的量浓度的溶液时,可用两只250 mL的容量瓶
B.用渗析法分离淀粉中混有的NaCl杂质
C.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
D.用碱式滴定管量取20.00 mL高锰酸钾溶液
E.在氢氧化铁胶体中加入少量硫酸会产生沉淀
F.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
G.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
解析:(1)量筒没有“0”刻度,且读数从上到下逐渐减小;滴定管有“0”刻度,且读数从上到下逐渐增大;滴定管读数时,估读到0.01 mL.
(2)配制500 mL溶液,只能用500 mL容量瓶;高锰酸钾溶液应装在酸式滴定管中;浓硫酸沾到皮肤上,应用干布擦掉,再用水冲洗;装硝酸的试剂瓶中不能用橡胶塞,只能用玻璃塞.
答案:(1)量筒 22.80 mL (2)BCE
16.“封管试验”具有简易、方便、节约、绿色等优点.观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是( )
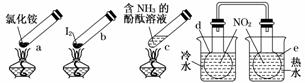
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.e内气体颜色变浅,d内气体颜色加深
解析:A项说明NH4Cl稳定性不好;C项加热时NH3逸出,红色变浅;D项热水中平衡向生成NO2的方向移动,气体颜色变深.
答案:B
15.用下图所示实验装置进行的实验中,能达到相应实验目的的是( )

A.装置甲:防止铁钉生锈
B.装置乙:除去乙烯中混有的乙炔
C.装置丙:实验室制取乙酸乙酯
D.装置丁:验证HCl气体在水中的溶解性
解析:甲中铁钉作阳极失电子被腐蚀;乙中酸性高锰酸钾溶液与乙烯和乙炔都反应;丙中应该用饱和碳酸钠溶液作吸收剂.
答案:D
14.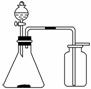 利用下列各组中的物质制备并收集少量相应的气体,能采用右图所示装置的是( )
利用下列各组中的物质制备并收集少量相应的气体,能采用右图所示装置的是( )
①浓氨水和固体NaOH制NH3
②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2
④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2
⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2
⑧乙醇和浓硫酸制C2H4
A.②③ B.①⑥⑦
C.②⑤⑧ D.①④⑥
D.①④⑥
解析:该装置的特点是固体与液体不需要加热生成密度比空气大的气体.②、③均满足;①、⑦生成的气体密度比空气小,应用向下排空气法收集,⑤、⑧反应均需加热,④、⑥生成的气体均不能用排空气法收集.
答案:A
13.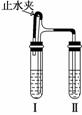 (2010·浙江丽水一模)用如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由澄清变浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
(2010·浙江丽水一模)用如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由澄清变浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
|
|
A |
B |
C |
D |
|
Ⅰ |
CaCO3、稀盐酸 |
Na2CO3、稀硫酸 |
Zn、稀盐酸 |
Cu、稀硫酸 |
|
Ⅱ |
Ca(OH)2 |
NaCl |
AgNO3 |
Ba(OH)2 |
解析:采用淘汰法.A选项要仔细分辨,开始时Ⅱ中溶液会先变浑浊,当关闭止水夹后,由于气体压强的缘故,Ⅰ中的溶液被压入Ⅱ中,由于盐酸的作用,Ⅱ中溶液应该由浑浊变澄清,不符合题意;B选项Ⅱ中有气泡产生,但其溶液不会变浑浊;C选项产生H2,关闭止水夹后,由于气体压强的缘故,将Ⅰ中的溶液压入Ⅱ中,会反应生成AgCl难溶物,使溶液变浑浊.D选项中Cu和稀硫酸不能反应.
答案:C
12.为了制得较纯净的物质,下列方法正确的 是( )
是( )
A.向Na2SO3晶体中加入浓盐酸制SO2气体
B.将H2S气体通入足量FeCl3溶液中,过滤得FeS
C.用FeS与稀HNO 3反应制取H2S气体
3反应制取H2S气体
D.向含有Cu2+的FeSO4溶液中加入过量Fe粉,振荡过滤后得FeSO4溶液
解析:选项A,浓盐酸易挥发,制备的SO2气体中混有挥发出来的HCl,故不纯;选项B,硫化氢气体通入足量氯化铁溶液中,得到的是S沉淀、FeCl2和HCl溶液,得不到FeS沉淀;选项C,FeS与稀硝酸反应得不到H2S气体,因为硝酸具有强氧化性可将硫化氢氧化;选项D,加入过量铁粉,可将Cu2+全部转化为不溶的Cu析出,过量的铁粉与铜通过过滤而除去,故可以得到纯净的FeSO4溶液.
答案:D
11.下列叙述中不正确的是( )
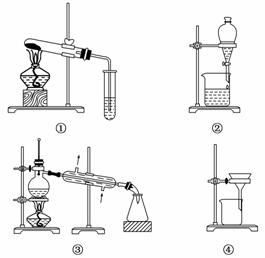
A.可用装置①鉴别碳酸钠和碳酸氢钠
B.可用装置②分离汽油和水的混合物
C.可用装置③从海水中蒸馏得到淡水
D.可用装置④把胶体粒子从分散系中分离出来
解析:A项中碳酸钠和碳酸氢钠的热稳 定性不同,可用加热的方法鉴别;B项中汽油和水互不相溶,可用分液的方法分离;C项中海水蒸馏可以得到淡水;D项中把胶体粒子从分散系中分离出来,应用渗析的方法,故D项错误.
定性不同,可用加热的方法鉴别;B项中汽油和水互不相溶,可用分液的方法分离;C项中海水蒸馏可以得到淡水;D项中把胶体粒子从分散系中分离出来,应用渗析的方法,故D项错误.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com