
题目列表(包括答案和解析)
12.(10分)(2010·上海高考)CaCO3广泛存在于自然界,是一种重要的化工原料.大理石主要成分为CaCO3,另外有少量的含硫化合物.实验室用大理石和稀盐 酸反应制备CO2气体.下列装置可用于CO2气体的提纯和干燥.
酸反应制备CO2气体.下列装置可用于CO2气体的提纯和干燥.

完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应 选用的仪器是________.
选用的仪器是________.
a.烧杯 b.玻璃棒
c.量筒 d.容量瓶
(2)上述装置中,A是________溶液,NaHCO3溶液可以吸收________.
(3)上述装置中,B物质是________.用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果______(填“偏高”、“偏低”或“不受影响”).
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的 主要实验步骤设计如下:
主要实验步骤设计如下:
剪碎、称重―→浸泡溶解―→过滤―→残渣烘干―→冷却、称重―→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是________.
a.氯化钠溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________.
(6)上述测定实验中,连续________,说明样品已经恒重.
解析:(1)考查等体积比浓度的溶液配制,用量筒量取等体积水与浓盐酸,倒入烧杯,搅拌混合即可.
(2)由于制备得到的CO2中含H2S以及反应挥发出的HCl,因此,可通过CuSO4溶液除去H2S,通过饱和NaHCO3溶液除去HCl.
(3)固体B应为无水CaCl2,可除去CO2中的H2O(g),如果CaCl2失效,则气体的CO2与H2O(g)的混合气体,其平均分子是小于CO2的分子量,因此测定结果偏低.
(4)要溶于CaCO3应选用稀醋酸,不能用稀H2SO4,原因是H2SO4与CaCO3生成微溶水的CaSO4.阻止H2SO4与CaCO3的进一步反应;正己烷用于溶解石蜡.
(5)先用正己烷溶解石蜡,才能使其中的CaCO3与醋酸充分接触发生反应,使二者达到最大溶出量.
(6)两次称量的质量差不超过0.001 g,说明已经恒重.
答案:(1)abc (2)CuSO4溶液或酸性KMnO4溶液 HCl气体或酸性气体 (3)无水CaCl2 偏低 (4)bd (5)石蜡 CaCO3
(6)两次称量的结果相差不超过(或小于)0.001 g
11.(12分)检查装置气密性是化学实验中的重要操作之一.试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是________(填序号,下同).
A.容量瓶 B.洗气瓶
C.分液漏斗 D.酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中正确的是________.
A.收集不到气体  B.造成环境污染
B.造成环境污染
C.观察到的实验现象有误 D.引发爆炸事故
(3)为检查如图所示简易气体发生装置的气密性,
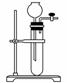 甲、乙两位同学进行了以下操作和方案设计.
甲、乙两位同学进行了以下操作和方案设计.
①甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好.经检验他的方案可行.则甲同学的操作方案、现象和结论是____________________
________________________________________________.
②乙同学设计的方案是:往漏斗中注入一定量的水至浸没长颈漏斗下端.关闭活塞,用手捂住试管中上部,待漏斗中液面上升一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中液面低于试管中液面且不再升降,说明气密性良好.乙同学设计方案的原理是____________________________________________________________________.
解析:(1)容量瓶、分液漏斗、滴定管均不需要检查是否漏气,而是检查其是否漏液.
(2)使用有毒气体时,若不检验气密性,可能会出现漏气,造成A、B、C的后果;如果易燃气体泄漏,则可能发生爆炸事故.
(3)对于气密性的检验而言,主要看在密闭体系中是否能形成压强差.
答案:(1)B (2)A、B、C、D
(3)①关闭活塞,通过长颈漏斗向试管中加水至漏斗导管中液面高于试管中的液面,停止加水,若液面差保持不变,说明气密性良好.
②乙同学操作若在装置不漏气的情况下,试管上部空间中气体压强小于大气压,则有“漏斗中液面低于试管中液面且不再升降”的现象
10.(2010·重庆高考)下列实验装置(固定装置略去)和操作正确的是( )

解析:氢氧化钠溶液应该用碱式滴定管盛装,B错;HCl在NaOH溶液中极易溶解,漏斗不应该没入溶液中,C错;中和热的测定实验中,温度计应该插入反应液中,D错.
答案:A
9.某学生提供的实验数据如下,其中肯定错误的是( )
①用100毫升的量筒量取67.60 mL的液体 ②用托盘天平称取22.5 g KCl ③酸碱中和滴定时,消耗0.100 0 mol/L的盐酸23.25 mL ④用广泛pH试纸测得某溶液的pH=4.4
A.①② B.②③
C.③④ D.①④
解析:量筒是粗量器,读数时不需要估读,①错误;广泛pH试纸变色范围是1-14,测得的pH只能是整数,④错误.
答案:D
8.有关实验的叙述,正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
解析:A项,固体应先在烧杯中溶解,并冷却至室温,再转移至容量瓶中,定容;B项,使用pH试纸时不能润湿;C项,进行焰色反应时,应用稀盐酸洗涤铂丝.
答案:D
7.下列实验操作或对实验事实的叙述正确的是( )
A.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断
搅拌
B.常温时,用pH试纸测得0.1 mol/L碳酸钠溶液的pH=7
C.如果皮肤上不慎沾上苯酚,应立即用大量的NaOH稀溶液冲洗
D.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
解析:Na2CO3是强碱弱酸盐,其溶液pH>7,B错误;苯酚沾到皮肤上应立即用酒精冲洗,NaOH溶液具有强腐蚀性,且中和放热,C错误;Fe(OH)3胶体制备方法是将饱和FeCl3溶液滴入沸水中,D错误.
答案:A
6.下图为课本中的插图,下列操作不合理的是( )

解析:观察钾的焰色反应时,一定要透过蓝色钴玻璃.选项C错误.
答案:C
5.(2010·安徽高考)下列实验操作或装置符合实验要求的是( )

A.量取15.00 mL NaOH溶液
B.定容
C.电解制Cl2和H2
D.高温煅烧石灰石
解析:B项的胶头滴管不能伸入容量瓶中;C项阳极材料铜是活泼电极,阳极铜放电,不符合实验要求;D项灼烧过程中会产生CO2气体,坩埚不能加盖.
答案:A
4.(2010·西城模拟)下列有关化学实验的叙述中,正确的是( )
A.中和滴定实验中应用待测液润洗锥形瓶
B.蒸馏操作时应将温度计的水银球插入液面下
C.倾倒液体时试剂瓶标签面向手心
D.NaO H溶液应保存在带玻璃塞的试剂瓶中
H溶液应保存在带玻璃塞的试剂瓶中
解析:中和滴定实验中锥形瓶不能用待测液润洗,A错;蒸馏操作时温度计的水银球应位于蒸馏烧瓶支管口处,B错;玻璃的主要成分为SiO2,NaOH能与SiO2反应生成胶状的Na2SiO3,容易使瓶塞和瓶口粘连,因此NaOH溶液应保存在带橡皮塞的试剂瓶中,D错.
答案:C
3.下列选用的相关仪器符合实验要求的是( )
|
A |
B |
C |
D |
|
存放浓硝酸 |
分离水和乙酸乙酯 |
准确量取9.50 mL水 |
实验室制取乙烯 |
 |
 |
 |
 |
解析:浓硝酸具有强氧化性且易挥发,故不能用橡胶塞,一般用玻璃塞,A项错误;水和乙酸乙酯互不相溶且二者密度不同,可以用分液漏斗分离,B项正确;量筒量取液体只能精确到0.1 mL,C项错误;实验室制取乙烯需要控制温度在170℃,量程为100℃的温度计不能满足实验要求,D项错误.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com