
题目列表(包括答案和解析)
8.某同学用下列实验装置探究硝酸的性质,根据图示判断下列结论不正确的是( )
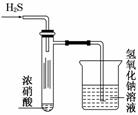
A.试管内壁上“黄霜”的成分是硫
B.该实验探究既说明浓硝酸具有氧化性,又说明浓硝酸具有挥发性
C.烧杯内的氢氧化钠溶液的作用是除去尾气,防止尾气污染环境
D.试管中的浓硝酸可以用浓盐酸代替
解析:试管中的浓硝酸挥发,遇到H2S气体,与之反应生成单质S;烧杯中的NaOH与逸出的酸性气体反应,防止这些酸性气体污染环境;浓盐酸无强氧化性,不能代替浓硝酸完成该实验.
答案:D
7.在如图所示装置进行实验,将液体逐滴加入到固体中,下列叙述不正确的是( )
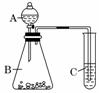 A.若A中为醋酸,B中为贝壳粉末,C中盛C6H5ONa溶液,则C中溶液变浑浊
A.若A中为醋酸,B中为贝壳粉末,C中盛C6H5ONa溶液,则C中溶液变浑浊
B.若A中为食盐水,B中为电石,C中盛KMnO4溶液,则C中溶液紫色褪去
C.若A中为浓氨水,B中为生石灰,则C中无现象
D.实验中仪器A可起到便于操作、防止气体从漏斗内逸出的作用
解析:浓氨水滴加到生石灰上,由于生石灰与水反应而消耗水且同时放出大量热,减小了NH3的溶解度,故有大量NH3逸出,且NH3易溶于水,C中易发生倒吸.
答案:C
6.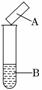 (2010·邯郸模拟)用试纸检验气体性质是一种重要的实验方法.如图所示的
(2010·邯郸模拟)用试纸检验气体性质是一种重要的实验方法.如图所示的
实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
|
选项 |
试剂B |
湿润的试纸A |
现象 |
结论 |
|
A |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
|
B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气为碱性气体 |
|
C |
Na2SO3,硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
|
D |
Cu,浓硝酸 |
KI淀粉试纸 |
变蓝 |
NO2为酸性气体 |
解析:选项A,碘水中的I2与淀粉作用出现蓝色,与I2的氧化性无关.选项B,NH3遇红色石蕊试纸变蓝,证明NH3是一种碱性气体.选项C,Na2SO3与H2SO4反应产生SO2,SO2使品红试纸褪色,证明SO2具有漂白性.选项D,Cu与浓HNO3反应产生NO2,NO2氧化I-生成的I2与淀粉作用变蓝,证明NO2具有氧化性而不是酸性.
答案:C
5.在实验室进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.CCOCuO△CO2Na2CO3
B.CuCu(NO3)2溶液Cu(OH)2
C.FeFe2O3Fe2(SO4)3溶液
D.CaOCa(OH)2溶液NaOH溶液
解析:方案A中碳在空气中燃烧主要生成CO2;方案B中使用到价格昂贵的AgNO3,经济上不合算;方案C中Fe在O2中燃烧生成Fe3O4而不是Fe2O3.方案D原理上正确,操作上可行,且CaO廉价易得.
答案:D
4.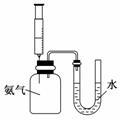 某同学用规格为100 mL的集气瓶收集了一瓶干燥的氨气,然后按照右图连接好装置,向集气瓶中注入1 mL水.一段时间后,U形管水柱变化( )
某同学用规格为100 mL的集气瓶收集了一瓶干燥的氨气,然后按照右图连接好装置,向集气瓶中注入1 mL水.一段时间后,U形管水柱变化( )
A.左高右低
B.左低右高
C.U形管中水的高度左右相同
D.U形管中没有水
解析:1体积水可以溶解约700体积的氨气,因此集气瓶中的氨气可以完全溶解在1 mL水中,导致U形管左侧压强减小至零,故U形管中的水完全被吸入集气瓶中.
答案:D
3.下列化学实验事实及其解释都正确的是( )
A.向KMnO4溶液中滴加盐酸,KMnO4溶液的氧化能力增强.说明盐酸具有氧化性
B.向澄清的AlCl3稀溶液中加入NaOH浓溶液,振荡,溶液仍为澄清.说明该两种溶液混合是物理变化
C.向FeCl3溶液中加入过量Cu粉,振荡、静置,溶液由黄色变为绿色.说明Fe3+具有氧化性
D.向CaCl2溶液中通入少量二氧化碳,产生白色沉淀.说明CaCO3难溶于水
解析:向KMnO4溶液中滴加盐酸后其氧化能力增强的原因是溶液 呈酸性;AlCl3与足量的NaOH溶液反应生成NaAlO2,属于化学变化;向FeCl3溶液中加入过量Cu粉生成绿色的FeCl2和CuCl2的混合溶液;向CaCl2溶液中通入少量二氧化碳不能产生CaCO3沉淀.
呈酸性;AlCl3与足量的NaOH溶液反应生成NaAlO2,属于化学变化;向FeCl3溶液中加入过量Cu粉生成绿色的FeCl2和CuCl2的混合溶液;向CaCl2溶液中通入少量二氧化碳不能产生CaCO3沉淀.
答案:C
2.(2010·广东高考有改动)对实验Ⅰ-Ⅳ的实验现象预测正确的是( )
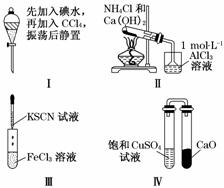
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液颜色变为浅绿色
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
解析:本题考查化学实验,意在考查考生对化学实验的操作和分析能力.实验Ⅰ中振荡静置,由于碘在CCl4中的溶解度大于在水中的溶解度,又CCl4的密度大于水的密度且二者互不相溶,故上层为水,几乎无色,下层为碘的四氯化碳溶液,显紫红色,A项错误;实验Ⅱ中NH4Cl和Ca(OH)2共热时生成NH3,NH3通入AlCl3溶液中产生Al(OH)3白色沉淀,但沉淀不溶于氨水,B项错误;实验Ⅲ中Fe3+遇到SCN-显红色,C项错误;实验Ⅳ中右边试管中CaO能够吸收左边试管中的水蒸气并与水反应,因此左边试管中饱和硫酸铜溶液中有蓝色晶体析出,D项正确.
答案:D
1.(2010·江苏高考)下列有关实验原理或操作正确的是( )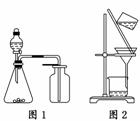
A.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
B.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.用广泛pH试纸测得0.10 mol·L-1 NH4Cl溶液的pH=5.2
解析:A项,NO可与O2反应生成NO2,不能用排空气法收集,故不正确;B项,正确;C项,洗涤沉淀时不能用玻璃棒搅拌,否则滤纸会被搅破,故不正确;D项,广泛pH试纸只能测到溶液pH的整数位,故不正确.
答案:B
5.(2010·全国卷Ⅰ)请设计CO2在高温下与木炭反 应生成CO的实验.
应生成CO的实验.
(1)在下面方框中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:


(2)根据方框中的装置图,填写下表:
|
仪器标号 |
仪器中所加物质 |
作用 |
|
A |
石灰石、稀盐酸 |
石灰石与盐酸作 用产生CO2 |
|
|
|
|
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中.改进后的优点是________________________________________________________
________________________________________________________________________;
(4)验证CO的方法是________________________________________________________
________________________________________________________________________.
解析: 本题主要考查化学实验,意在考查考生实验设计和评价能力.(1)依据本题实验目的,需要设计实验CO2与木炭在高温条件下反应生成CO,题目已给出了CO2的制备装置,需要依次设计的是:CO2的除杂装置,CO2的干燥装置,CO2与木炭在高温条件下的反应装置,CO除杂装置.(2)CO2的除杂装置中可用NaHCO3溶液,CO2的干燥装置中可用浓硫酸,CO2与木炭在高温条件下的反应装置中要有木炭,CO除杂装置要吸收CO2,要用碱液.(3)题给装置不易控制气体生成的快慢且长颈漏斗容易漏气,用长颈漏斗和小试管就避免了这一问题.(4)要检验CO的存在,可将其点燃,再检验其产物中是否有CO2生成.
本题主要考查化学实验,意在考查考生实验设计和评价能力.(1)依据本题实验目的,需要设计实验CO2与木炭在高温条件下反应生成CO,题目已给出了CO2的制备装置,需要依次设计的是:CO2的除杂装置,CO2的干燥装置,CO2与木炭在高温条件下的反应装置,CO除杂装置.(2)CO2的除杂装置中可用NaHCO3溶液,CO2的干燥装置中可用浓硫酸,CO2与木炭在高温条件下的反应装置中要有木炭,CO除杂装置要吸收CO2,要用碱液.(3)题给装置不易控制气体生成的快慢且长颈漏斗容易漏气,用长颈漏斗和小试管就避免了这一问题.(4)要检验CO的存在,可将其点燃,再检验其产物中是否有CO2生成.
答案:(1)
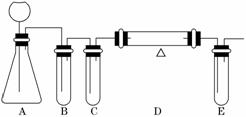
(2)
|
仪器标号 |
仪器中所加物质 |
作用 |
|
B |
饱和碳酸氢钠溶液 |
除去CO2中的 HCl气体 |
|
C |
浓硫酸 |
除去CO2中的水蒸气 |
|
D |
干燥木炭粉 |
与CO2反应产生CO |
|
E |
澄清石灰水 |
吸收未反应的CO2 |
(3)可以通过控制加酸的量,来控制气体产生的快慢;同时小试管中充满盐酸,可以起到液封作用,防止反应激烈时气体经漏斗冲出
(4)点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
[发展等级评价]
(限时45分钟,满分100分)
4.(2010·湘潭模拟)大胆、科学的假设与猜想是科学探究的先导和价值所在.在下列假设(猜想)引导下的探究肯定没有意义的是( )
A.探究SO2与Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是H ClO的漂白性所致
ClO的漂白性所致
解析:因为H2O中O若变成O2,则氧元素价态升高,水是还原剂,但单质钠只能作还原剂.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com