
题目列表(包括答案和解析)
4.(2010·德阳模拟)下列有关化学实验的操作或说法中,正确的是( )
A.为检验酸性溶液中的Cl-和SO,要先加硝酸银溶液,滤去沉淀后再加硝酸钡溶液
B.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,会导致测定结果偏低
C.配制溶液的操作中,转移溶液后,玻璃棒、烧杯未洗涤使得所配溶液浓度偏高
D.除去FeCl2溶液中少量的FeCl3,采取的措施是加入足量铁屑充分反应后过滤
解析:选项A,加入AgNO3溶液时,Cl-、SO均能与Ag+反应产生沉淀.选项B,中和滴定实验中锥形瓶中有少量蒸馏水对测定结果无影响.选项C,该操作损失了部分溶质,使所配溶液浓度偏低.选项D,FeCl3与过量的Fe反应生成FeCl2,过滤除去Fe,滤液即为FeCl2溶液,正确.
答案:D
3.(2009·惠州模拟)除去下列物质中所含少量杂质的方法不正确的是( )
|
|
物质 |
杂质 |
试剂 |
提纯方法 |
|
A |
CO2 |
HCl |
饱和Na2CO3溶液 |
洗气 |
|
B |
BaSO4 |
BaCO3 |
稀盐酸 |
溶解、过滤、洗涤 |
|
C |
乙酸乙酯 |
乙酸 |
饱和Na2CO3溶液 |
混合振荡、静置分液 |
|
D |
蛋白质 |
NaCl |
H2O |
渗析 |
解析:A项中CO2能与Na2CO3溶液反应生成NaHCO3,应将除杂试剂Na2CO3溶液换为饱和NaHCO3溶液.
答案:A
2.以下实验装置一般不用于分离物质的是( )
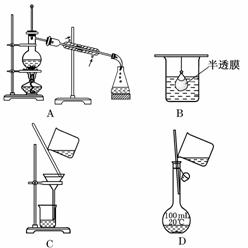
解析:选项A用于分离两种沸点不同的液体混合物;选项B是渗析,可用于分离胶体与溶液;选项C用于固体与溶液的分离;选项D用于配制一定物质的量浓度的溶液.
答案:D
1.下列实验方法正确的是( )
①用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液 ②用闻气味的方法鉴别化纤织物和纯毛织物 ③用碘水检验淀粉水解是否完全 ④用蒸馏法分离乙酸乙酯和饱和碳酸钠溶液
A.③ B.②③
C.①③ D.①④
解析:①中Na2CO3与NaHCO3溶液均能与澄清石灰水反应生成CaCO3沉淀;②中要先灼烧再闻气味,直接闻气味不能鉴别;④中用分液法分离.
答案:A
5.(2010·广东高考)碳酸锂广泛应用于陶瓷和医药等领域,以β锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
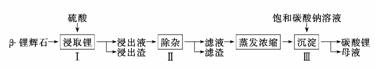
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g.
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是________________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0-6.5,沉淀部分杂质离子,然后分离得到浸出液.
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有__________________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为______________________________________
________________________________________________________________________.
(5)从母液中可回收的主要物质是_____________________________________________.
解析:(1)对β锂辉石进行粉碎处理的目的是,增大锂辉石粉末与硫酸的接触面积,使锂辉石与硫酸充分反应,提高浸出率.
(2)步骤Ⅰ所要加入的物质,其主要作用是增大溶液的pH,将溶液的pH调节到6.0-6.5,分析所提供的备选物,只有石灰石能达到目的.
(3)步骤Ⅰ处理后的浸出液中,已经除去了Al3+、Fe3+,加入H2O2会将Fe2+氧化为
Fe3+,加入石灰乳则可将氧化所得的Fe3+和Mg2+除去,再加入Na2CO3则可除去所加入的过量Ca2+.
(4)生成沉淀的主要反应为2Li++CO===Li2CO3↓.
(5)母液中留下的主要离子为Na+和SO,所以回收所得物质为Na2SO4.
答案:(1)增大固液接触面积,加快浸出反应速率,提高浸出率
(2)石灰石 (3)Fe2+、Mg2+、Ca2+
(4)2Li++CO===Li2CO3↓ (5)Na2SO4
[发展等级评价]
(限时45分钟,满分100分)
4.(2010·重庆高考)能鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是( )
A.HNO3 B.KOH
C.BaCl2 D.NaClO
解析:在四种溶液中滴入硝酸时的现象分别是变黄色(碘水)、无现象、产生气体(二氧化碳)和先出现沉淀后溶解;KOH不能鉴别Na2CO3和NaAlO2;BaCl2滴入四种溶液中,MgI2和NaAlO2无明显现象,AgNO3和Na2CO3溶液中都产生白色沉淀,无法区别;NaClO与Na2CO3、NaAlO2都不反应.
答案:A
3.(2010·崇文模拟)根据下列实验内容得出的结论正确的是( )
|
选项 |
实验内容 |
结论 |
|
A |
某物质的水溶液能使红色石蕊试纸变蓝 |
该物质一定是氨气 |
|
B |
某气体能使湿润的淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液中加入盐酸产生无色无味气体 |
该溶液中一定含有大量碳酸根离子 |
|
D |
向铁和稀硝酸反应后的溶液中滴加KSCN溶液,溶液显红色 |
反应后溶液中肯定有Fe3+,可能还有Fe2+ |
解析:A项,该物质是NaOH、KOH也可以,不一定是氨气,不正确;B项,该气体也可以是NO2、O3等气体,不一定是氯气,不正确;C项,该溶液中也可能含碳酸氢根离子,不一定含碳酸根离子,不正确;D项,能遇KSCN显红色的溶液中肯定有Fe3+,若铁过量,则2Fe3++Fe===3Fe2+,故可能有Fe2+,正确.
答案:D
2.(2010·唐山模拟)用可溶性钡盐检验SO的存在时,先在待测溶液中加入盐酸,其作用是( )
A.形成较多的白色沉淀
B.形成的沉淀纯度更高
C.排除Ba2+以外的其他阳离子的干扰
D.排除SO以外的其他阴离子及Ag+的干扰
解析:阴离子CO、SO也可与Ba2+形成白色沉淀;若溶液中含有Ag+,则加入氯化钡溶液,Ag+与Cl-形成白色的AgCl沉淀.这些杂质形成的白色沉淀干扰了SO的检验.
答案:D

[基础等级评价]
1.(2010·邯郸模拟)现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
解析:汽油与NaCl溶液不互溶,产生分层现象,故可用分液法分离;乙醇和水的沸点差异较大,故可采用蒸馏法分离;利用汽油等萃取剂可萃取Br2.
答案:C
5.(2010·襄樊模拟)某兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd).请回答下列问题:
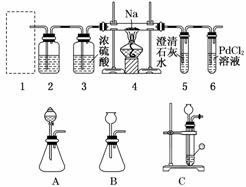
(1)上图装置2中应盛放________溶液.
(2)为了使反应随开随用,随关随停,上图方框内应选用________装置(填上图字母代号).
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前 ,应先进行1装置的操作,待装置________(填数字编号)中出现______________________现象时,再点燃酒精灯,这步操作的目的是_____________________________________________________________.
,应先进行1装置的操作,待装置________(填数字编号)中出现______________________现象时,再点燃酒精灯,这步操作的目的是_____________________________________________________________.
(4)①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_____________________
__________________________________________________.
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_________________________
__________________________________________________________.
(5)该小组查阅资料认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳.当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有Na2CO3、Na2O和C:_______________________________________________________
________________________________________________________________________________________________________________________________________________.
解析:(1)根据实验装置图可知,装置1为CO2的发生装置,利用碳酸钙和稀盐酸的反应制取CO2;装置2为CO2的净化装置,利用饱和NaHCO3溶液除去HCl.
(2)为了能够随时控制反应的发生和停止,应选择装置C中的启普发生器的简易装置.
(3)由于Na和氧气加热时剧烈反应,因此待装置5中澄清石灰水变浑浊,才开始点燃酒精灯,主要是为了排空装置内的空气.
(4)①根据题目信息知,Na与CO2反应时生成CO和碳酸钠,其化学方程式为:2Na+2CO2===Na2CO3+CO.②根据题目信息知,Na与CO2反应时生成碳酸钠和另一固体物质,而无CO生成,则其化学方程式为:4Na+3CO2===2Na2CO3+C.
(5)根据溶解性可以检验出C;根据Na2CO3和Na2O的性质检验Na2CO3和Na2O.
答案:(1)饱和NaHCO3溶液 (2)C
(3)5 澄清石灰水变浑浊 排除装置内的空气
(4)①2Na+2CO2===Na2CO3+CO
②4Na+3CO2===2Na2CO3+C
(5)取少量装置4中的残留固体溶于水,若有黑色不溶颗粒,则说明残留固体中有碳;在所得水溶液中再加入过量BaCl2溶液,若有沉淀生成,则说明残留固体中有Na2CO3;过滤,用pH试纸检验滤液,若滤液呈碱性,则残留固体中含有Na2O.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com